微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是………?(?)
2NH3一定处于平衡状态的是………?(?)
A.N2、H2、NH3的百分含量相等
B.3v(N2)正= v(H2)逆
C.定容容器中,气体的密度不变
D.N2、H2、NH3的浓度之比为1:3:2
参考答案:B
本题解析:A.当反应达到平衡状态时反应混合物中任何组分的物质的量、物质的量浓度不变。但是N2、H2、NH3的百分含量可能相等也可能不等。错误。B.在任何时刻v(N2)正= 3v(H2)正,而3v(N2)正= v(H2)逆;则v(H2)正= v(H2)逆反应达到平衡。正确。C.因为反应是在定容容器中进行,反应前后 的质量不变,所以无论反应是否达到平衡,气体的密度都不变。因此不能作为判断平衡的标志。错误。D.当反应达到平衡时,N2、H2、NH3的浓度之比可能为1:3:2,也可能不是。因此不能作为判断反应是否达到平衡的标志。错误。
本题难度:一般
2、填空题 如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL。在相同温度和相同催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)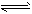 C(g)+2D(g) △H<0 达到平衡(Ⅰ)时,V(乙) =0.86V L。
C(g)+2D(g) △H<0 达到平衡(Ⅰ)时,V(乙) =0.86V L。
请回答
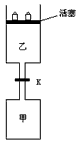
(1)乙中B的转化率为___________;
(2)甲中D和乙中C的物质的量比较:___________(填“相等”、“前者大”、 “后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为___________(用含V的代数式表示,连通管中气体体积忽略不计。)
参考答案:(1)20%
(2)后者大
(3)0.29VL
本题解析:
本题难度:一般
3、填空题 反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率如下所示:
2C(g)+2D(g)在四种不同情况下的反应速率如下所示:
①v(A)= 0.15?mol/(L s);②v(B)=0.6mol/(L
s);②v(B)=0.6mol/(L s);③v(C)= 0.4?mol(L
s);③v(C)= 0.4?mol(L s);④v(D)=0.45?mol/(L
s);④v(D)=0.45?mol/(L s)。该反应进行的快慢顺序为_________。
s)。该反应进行的快慢顺序为_________。
参考答案:④>③=②>①
本题解析:
本题难度:一般
4、填空题 一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是?(填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为?;②达到平衡时反应放出的热量为?;③此温度下该反应的平衡常数K=?。?
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
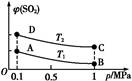
①温度关系:T1?T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA?KB,KA?KD。
参考答案:(1)b、d、e (2)①90% ②35.28 kJ ③20 250
(3)①< ②= >
本题解析:(1)SO2、O2、SO3三者浓度比为2∶1∶2,与平衡状态无必然联系,不能作为建立平衡的标志,容器内气体压强随反应进行而变化,气体压强不变,则建立平衡;气体总质量不变,容器体积不变,混合气体密度也不变,不能作为平衡状态标志;SO3的物质的量是随反应进行而发生变化的,当其不变时,表示反应已建立平衡;SO2的生成速率是v(SO2)逆,SO3生成速率是v(SO3)正,而v(SO2)正=v(SO3)正,则有v(SO2)逆=v(SO2)正,这是平衡建立的根本标志。所以可作为平衡状态标志的是b、d、e。
(2)? 2SO2(g)+O2(g)? ?2SO3(g)
?2SO3(g)
起始(mol)? 0.4? 0.2?0
变化(mol)? x?x/2?x
平衡(mol)? 0.4-x ?0.2-x/2 ?x
T、V恒定,气体的压强之比等于物质的量之比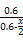 =
=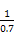 ,解得x=0.36,故SO2转化率为:
,解得x=0.36,故SO2转化率为: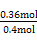 ×100%=90%。放出热量为:
×100%=90%。放出热量为: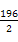 ?kJ·mol-1×0.4 mol×90%="35.28" kJ,K=
?kJ·mol-1×0.4 mol×90%="35.28" kJ,K=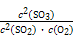 =
=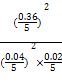 ="20" 250。
="20" 250。
(3)该反应是放热反应,温度升高平衡左移,SO2体积分数增大,所以T2>T1,平衡常数只与温度有关,温度不变,K值不变,则KA=KB,升温,平衡左移,K值减小,KA>KD。
本题难度:一般
5、选择题 下列事实能用勒夏特列原理来解释的是
A.由H2、I2、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.将木炭粉碎后与O2反应,速率更快
参考答案:B
本题解析:
答案:B
A.由H2、I2、HI组成的平衡体系是反应前后,分子数不变的反应,加压后颜色变深,是物理变化。
B.黄绿色的氯水光照后颜色变浅,是HClO见光分解了,使Cl2+H2O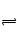 HCl+HClO平衡正向移动。
HCl+HClO平衡正向移动。
C.使用催化剂同等程度加快正逆反应的速率
D.将木炭粉碎后与O2反应,增大接触面积,速率更快
本题难度:一般