说明该溶液中一定含钠元素
参考答案:B
本题解析:A中结论不正确,酸性是碳酸的大于苯酚的。C中氢氧化钠没有过量,不能判断氢氧化铝是否溶于强碱。D中焰色反应中实验中应该用铂丝蘸取待测液,而是玻璃棒。答案选B。
本题难度:简单
2、简答题 碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用.甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图1:

①溶解大理石时,用硝酸而不用硫酸的原因是______.
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、______、______.
③“滤液A”中除H+离子外,还含有的阳离子是______;检验该阳离子的实验方法是:取少量滤液A与______在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可.
(2)乙组对某硫酸钙晶体(xCaS04?yH20)加热分解的有关反应进行探究.他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如图2所示.又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4 2CaO+2S02↑+O2↑.
①加热时,该晶体开始发生化学变化的时间是______(填“t1”、“t3”或“t5”).
②t4~t5时间段固体的化学式为______.
③tl~t2时间段固体发生反应的化学方程式为______.
参考答案:(1)①硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行,所以选择硝酸反应;
故答案为:硫酸钙微溶于水;
②上述流程中,“分离”得产品为碳酸钙沉淀和硝酸铵溶液,所包含的实验操作依次为过滤,洗涤,干燥;
故答案为:洗涤,干燥;
③大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有阳离子为氢离子,铵根离子;依据铵根离子的检验方法是和氢氧化钠反应生成氨气,遇到湿润的红色石蕊试纸变蓝证明氨气的生成;
故答案为:NH4+,烧碱;
(2)①依据图象分析,固体质量在0-t1时间段无变化,说明固体未反应,加热到t1时,固体质量开始减小,所以该晶体开始发生化学变化的时间是t1;
故答案为:t1;
②在加热到t1时xCaSO4?yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,t4~t5时间段固体的化学式为CaSO4;
故答案为:CaSO4;
③t3~t4时间段完全脱水,则m(H2O)=6.52g-5.44g=1.08g,m(CaSO4)=5.44g,n(H2O)=1.08g18g/mol=0.06mol,n(CaSO4)=5.44g136g/mol=0.04mol,所以n(CaSO4):n(H2O)=x:y=0.04:0.06=2:3,化学式为:2CaSO4?3H2O,tl~t2时间段固体质量变化,减少水的质量=6.52g-5.80g=0.72g,n(H2O)=0.72g18g/mol=0.04mol;固体质量为5.80g,6.52g硫酸钙固体物质的量=6.52g326g/mol=0.02mol,则1mol2CaSO4?3H2O失水2mol,反应的化学方程式为:2CaSO4?3H2O△.2CaSO4?H2O+2H2O,
故答案为:2CaSO4?3H2O△.2CaSO4?H2O+2H2O.
本题解析:
本题难度:简单
3、选择题 关于物质的分离提纯,说法错误的是( )
A.蒸发操作可以从溶液中分离得到可溶性固体溶质
B.将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘
C.蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处
D.可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出
参考答案:A.蒸发分离可溶性固体与液体,则蒸发操作可以从溶液中分离得到可溶性固体溶质,故A正确;
B.过滤的液体应利用玻璃棒引流,且使液面低于滤纸边缘,故B错误;
C.蒸馏时,测定馏分的温度,则蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处,故C正确;
D.植物油和水混合后分层,水在下层,则可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出,故D正确;
故选B.
本题解析:
本题难度:简单
4、实验题 (5分)现有A、B两种金属分别与盐酸反应,产生氢气的速率相近。请设计一个原电池实验证明A、B两种金属的活动性。
参考答案:将A、B两种金属片用导线连接放入盐酸中组成原电池,有气泡逸出的是较不活泼的金属,另一极即是活泼的金属。
本题解析:当活动性不同的金属组成原电池时,相对活泼金属失电子,在相对不活泼金属上氢离子得电子,析出氢气。
本题难度:简单
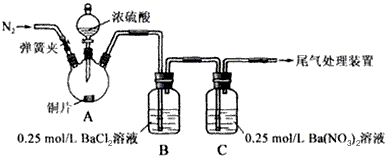
5、实验题 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
|