| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《难溶电解质的溶解平衡》高频试题特训(2017年最新版)(六)
参考答案:C 本题解析:A.生成BaSO4沉淀后的溶液中仍然存在Ba2+和SO42-,因为有BaSO4的沉淀溶解平衡存在,A错误;B.同类型物质的Ksp数值越小,溶解能力越小,不同类型的物质则不能直接比较,B错误;C.从减小BaSO4沉淀损失的角度而言,用稀H2SO4洗涤效果好,因为H2SO4可以抑制BaSO4的溶解,C正确;D.洗涤沉淀一般2~3次即可,次数过多会使沉淀溶解而减少,D错误,选C。 本题难度:一般 2、选择题 Ag2S中混有少量AgCl,可以把该混合物加入以下哪种溶液中除去AgCl?(?) 参考答案:C 本题解析:AgCl的溶解度大于Ag2S,所以将混有ACl的.Ag2S放入到Na2S溶液中形成更难溶的Ag2S而除去。答案选C。 本题难度:简单 3、选择题 已知几种难溶电解质的溶度积常数Ksp(25℃)见下表 参考答案:D 本题解析: 本题难度:一般 4、选择题 在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10) |
参考答案:A
本题解析:利用浓度商与溶度积的大小比较判断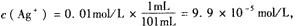
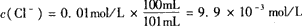 ,
,
Qc=" c(" Ag+)·c(Cl-)=9.9×10-5mol/L×9.9×10-3mol/L="9.8×" 10-7mol2.L-2>Ksp,故有AgCl沉淀生成。
考点:考查沉淀溶解平衡计算。
本题难度:一般
5、选择题 已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8?mol?L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5?mol?L-1.若在5mL含有KCl和KI各为0.01mol?L-1的溶液中,加入8mL001mol?L-1AgNO3溶液,下列叙述正确是( )
A.混合溶液中c?(K+)>c?(NO3-)>c?(Ag+)>c?(Cl-)>c?(I-)
B.混合溶液中c?(K+)>c?(NO3-)>c?(Cl-)>c?(Ag+)>c?(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中
| c(Cl-) c(I-) |
参考答案:AB.KCl、KI混合溶液中加入AgNO3溶液,先生成AgI,再生成AgCl,因为Ksp(AgI)<Ksp(AgCl),AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol?L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol?L-1×8 mL-5.0×10-5 mol=3.0×10-5 mol,而KCl为nn(KCl)=0.01mol?L-1×5 mL=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,离子浓度顺序为:c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-),故A错误,故B正确;
C.因为Ksp(AgI)<Ksp(AgCl),加入AgNO3溶液时首先生成AgI沉淀,故C错误;
D.混合溶液中c(Cl-)c(I-)=Ksp(AgCl)Ksp(AgI)=1.25×10-51.23×10-8≈1.03×103,故D错误;
故选B.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《无机非金属.. | |