微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
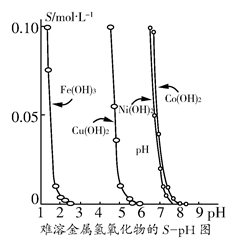
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质
| FeS
| MnS
| CuS
|
Ksp
| 6.3×10-18
| 2.5×10-13
| 1.3×10-35
|
物质
| PbS
| HgS
| ZnS
|
Ksp
| 3.4×10-28
| 6.4×10-33
| 1.6×10-24
|
?
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
参考答案:(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O (5)B
本题解析:由图可知,在pH=3时溶液中不会出现Cu(OH)2沉淀。
(2)要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右。
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,不能通过调控pH而达到分离的目的。
(4)Cu(OH)2(s) Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使三种杂质离子转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子。
本题难度:一般
2、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1L0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.lmol·L-1溶液中pH=l
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaC12反应产生沉淀
参考答案:D
本题解析: A、Ka(HF)=3.6×10-4,知其为弱酸,不可能完全电离,错误;B、Ksp(CaF2)与浓度无关,错误;C、混合后溶液中Ca2+浓度为0.1mol·L-1,F-浓度为 =0.6×10-2,浓度商为0.6×10-3> Ksp(CaF2)=1.46×10-10,会与沉淀出现,错误。D、正确。
=0.6×10-2,浓度商为0.6×10-3> Ksp(CaF2)=1.46×10-10,会与沉淀出现,错误。D、正确。
本题难度:一般
3、选择题 化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数
参考答案:B
本题解析:根据沉淀转化向溶度积小的方向进行,Ksp(MnS)>Ksp(CuS),A项正确;该反应达平衡时c(Mn2+)、c(Cu2+)保持不变,但不一定相等,B项错误;往平衡体系中加入少量CuSO4固体后,平衡向正反应方向移动,c(Mn2+)变大,C项正确;该反应的平衡常数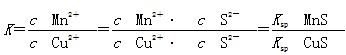 ,D项正确。
,D项正确。
本题难度:一般
4、选择题 某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复原来的温度.下列叙述正确的是( )
A.沉淀物的质量为5.6g
B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g
D.饱和石灰水的质量小于98.2g
参考答案:D
本题解析:向100g澄清石灰水中加入5.6g生石灰,反应如下:CaO+H2O=Ca(OH)2
5.6g 1.8g 7.4g,生成的7.4gCa(OH)2不能溶解,反应中消耗1.8g水,故与1.8g水对应的原溶质也要析出,
所以正确的答案选D。
本题难度:一般
5、选择题 下列说法中正确的是
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.绝对不溶解的物质是不存在的