| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《弱电解质电离平衡》考点强化练习(2017年押题版)(四)
参考答案:C 本题解析:根据NaHSO3+NaOH=Na2SO3+H2O,加入NaOH固体,溶液PH增大,A项错误;HSO3-的电离过程和水解过程都是吸热过程,温度升高,电离过程增大,水解程度增大,c(HSO3-)减小,B项错误;在同一溶液中,n(H+)?n(OH-)=C(H+)?c(OH-)V×V=KwV×V,加水稀释,KW不变,V增大,则加水稀释后,n(H+)与n(OH-)的乘积变大,C项正确;钠盐是强电解质,电离方程式为NaHSO3 = Na++HSO3-,D项错误;选C。 本题难度:一般 2、选择题 下列有关说法正确的是 参考答案:C 本题解析:A、醋酸是弱酸,水溶液中部分电离,所以pH>1,错误;B、铅蓄电池在放电过程中,负极是Pb发生氧化反应,质量减小,正极是PbO2发生还原反应,结合硫酸生成硫酸铅和水,pH增大,错误;C、反应CO2(g)+C(s)=2CO(g)的△S>0,低温下不能自发进行,所以其△H>0,正确;D、AgCl浊液中加入少量NaCl饱和溶液,有氯化银沉淀析出,氯离子浓度增大,c(Ag+)减小,但温度不变,Ksp(AgCl)不变,错误,答案选C。 本题难度:一般 3、选择题 已知相同温度下电离常数Ki(HF)>Ki(HCN)。在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是 参考答案:A 本题解析:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),排除D 本题难度:困难 4、选择题 在醋酸溶液中,CH3COOH的电离达到平衡的标志是 |
参考答案:C
本题解析:A、醋酸溶液显酸性,错误;B、溶液中若无醋酸分子,说明醋酸完全电离,错误;C、当醋酸的电离达到平衡状态时,溶液中的各离子的浓度保持不变,正确;D、醋酸是弱电解质,弱电解质的溶液中,始终是分子和离子共存的关系,与达到平衡无关,错误,答案选C。
考点:考查电离平衡的判断
本题难度:一般
5、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液) 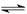 H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液: ①盐酸②石灰水③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
参考答案:C
本题解析:向溶液中加盐酸、硫酸氢钠溶液、氯化铝(水解生成盐酸)溶液c(H+)都增大,平衡向左移动,指示剂显红色;向溶液中加石灰水、碳酸氢钠溶液(水解生成氢氧化钠)、氨水c(OH-)都增大,平衡向右移动,溶液显黄色;溶液中加入氯化钠溶液平衡不移动,溶液显橙色。
考点:弱电解质电离平衡
点评:硫酸氢钠在水溶液中相当于一元酸。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《弱电解质电.. | |