微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在同温同压下,用等质量的H2、CH4、CO2、HCl四种气体分别吹起四个气球,其中是由CO2吹起的是

参考答案:D
本题解析:H2、CH4、CO2、HCl的摩尔质量分别是2 g·mol-1、16 g·mol-1、44 g·mol-1、36.5 g·mol-1质量相同的时候,根据n=m/M,CO2的物质的量最小,如果在同温同压下CO2的体积最小,故选D。
考点:
本题难度:一般
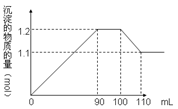
2、选择题 向100 mL BaCl2、AlCl3、FeCl3的混合液A中逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量和加入溶液B的体积关系如图所示:则Na2SO4与FeCl3的物质的量浓度之比为
A.1︰1
B.10︰1
C.2︰1
D.5︰1
参考答案:B
本题解析:
正确答案:B
观察图:可得以下结论,
(1)加入B溶液110 mL时,Al(OH)3沉淀溶解完全,剩下沉淀BaSO4、Fe(OH)3。
(2)90—100 mL时这10 mL B溶液的滴加、Al(OH)3沉淀的溶解及BaSO4沉淀的生成同时发生: Ba2++SO42―=BaSO4↓,Al(OH)3+OH-=AlO2―+2H2O,并且物质的量相等,得出Na2SO4与NaOH的物质的量相等,即浓度相同。
(3)根据100—110 mL时B溶解Al(OH)3?0.01 mol,可得出90—110 mL时B溶解Al(OH)3?0.02 mol;又根据90—100 mL时这10 mL B溶液生成BaSO4?0.01 mol,所以总共有BaSO4为0.1 mol,最后Fe(OH)3为0.11 mol-0.1 mol="0.01" mol。
得出Na2SO4与FeCl3的物质的量浓度之比为(0.1mol/0.1L):(0.01mol/0.1L)=10:1,B选项正确。
附:各种物质的浓度如下表
溶质
Na2SO4
NaOH
BaCl2
AlCl3
FeCl3
浓度/mol·L-1
1
1
1
0.2
0.1
本题难度:一般
3、填空题 标准状况下,① 4g氢气 ② 33.6L甲烷(CH4) ③ 6.02×1023个水分子中,含分子数最多的是(填写序号,下同)_____,含原子数最多的是_____,质量最大的是______,体积最小的是______。
参考答案: ①、②、②、③
本题解析:根据物质的量与摩尔质量、质量的关系,气体摩尔体积的计算和微粒数与物质的量、阿伏伽德罗常熟的关系进行计算:氢气的物质的量为2mol,质量为4g,氢气分子数为2NA,氢原子数为4NA,标准状况下的体积为44.8L;甲烷的物质的量为1.5mol,质量为24g,分子数为1.5NA,原子数为1.5NA×5=7.5NA,标准状况下的体积为33.6L;水的物质的量为1mol,质量为18g,分子数为1NA,原子数为1NA×3=3NA,水常温下是非气体,其体积约为18mL.综上分析,可知:含分子数最多的是①,含原子数最多的是②,质量最大的是②,体积最小的是③.答案为:①;②;②;③。
考点:考查物质的量与摩尔质量、质量的关系,气体摩尔体积、微粒数、物质的量、阿伏伽德罗常数计算。
本题难度:一般
4、选择题 有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,该80mL溶液的物质的量浓度为( )
A.5?mol?L-1
B.6?mol?L-1
C.6.25?mol?L-1
D.6.75?mol?L-1
参考答案:设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则有x×14%=(x-100g)×28%,解得x=200g,
故蒸发后溶液的质量为200g-100g=100g,
故28%的氢氧化钾溶液中含有氢氧化钾的物质的量为100g×28%56g/mol=0.5mol,
所得溶液的物质的量浓度为0.5mol0.08L=6.25mol/L,
故选C.
本题解析:
本题难度:一般
5、计算题 30 mL由CO2、CO、O2组成的混合气体,通过足量的Na2O2后体积变为28 mL,把剩下的气体引燃后,通过足量的NaOH溶液,最后剩余10 mL气体(所有气体体积在同温同压下测定)。求原混合气体中各成分的体积。
参考答案:①CO2:4 mL? CO:12 mL? O2:14 mL
②CO2:4 mL? CO:22 mL? O24 mL
本题解析:根据?2CO2+2Na2O2====2Na2CO3+O2? ΔV
2? 1? 1
V(CO2)? (30-28) mL
即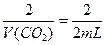 V(CO2)="4" mL,同时生成O2:2 mL,通过NaOH溶液,剩余10 mL气体则反应了的CO、O2共18 mL,
V(CO2)="4" mL,同时生成O2:2 mL,通过NaOH溶液,剩余10 mL气体则反应了的CO、O2共18 mL,
根据2CO? +? O2====2CO2
2? 1
18×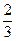 ? 18×
? 18×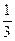
即参加反应的CO:12 mL,O2:6 mL。
若剩余10 mL O2,则原混合气体中含CO:12 mL,则含O2:(30-4-12) mL="14" mL;若剩余10 mL CO,则原混合气体中含O2:(6-2) mL="4" 91EXAm.org mL,则含CO:(30-4-4) mL="22" mL,故原混合气体中含CO2、CO、O2,分别为:4 mL、12 mL、14 mL或4 mL、22 mL、4mL。?
本题难度:简单