微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为?;
(2)此条件下该一元弱酸的电离平衡常数为?。
参考答案:
(1)0.025 mol·L-1?(2)4.0×10-5
本题解析:(1)首先求出题出所给的氢氧化钠的物质的量浓度c(NaOH):设盐酸和氢氧化钠的体积分别为1L和2L,那么有如下关系: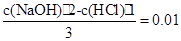 ,解之得:c(NaOH)="0.04" mol·L-1
,解之得:c(NaOH)="0.04" mol·L-1
用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,表明有如下关系:0.04 mol·L-1×12.5 mL=c(某酸) ×20 mL,解之得:c(某酸)=? 0.025 mol·L-1
(2)一元弱酸HA溶液pH=3,? HA?=? H+?+? A-
起始:? 0.025?0? 0
转化:?0.001? 0.001? 0.001
平衡:? 0.024? 0.001? 0.001
因此此条件下该一元弱酸的电离平衡常数为:?
本题难度:一般
2、选择题 下列对溶液pH的有关判断中,正确的是( )
A.随着温度的升高,Na2CO3溶液pH减小
B.随着温度的升高,纯水的pH增大
C.向0.1mol?L-1的CH3COOH溶液中加入少量CH3COONa晶体,溶液的pH增大
D.pH=2的醋酸溶液与pH=2的H2SO4溶液的物质的量浓度之比为2:1
参考答案:A、碳酸钠中碳酸根的水解反应方程式:CO32-+H2O?HCO3-+OH-,水解过程是吸热的,温度越高弱酸根离子的水解程度越大,随着温度的升高,水解平衡向右移动,氢氧根浓度增大,碱性增强,pH增大,故A错误;
B、温度越高越有利于水的电离,水的离子积常数越大,氢离子浓度越大,pH减小,故B错误;
C、CH3COOH溶液中加入少量CH3COONa晶体,CH3COO-对醋酸的电离起抑制作用,所以酸性减弱,溶液的pH增大,故C正确;
D、醋酸是弱电解质,不完全电离,pH=2的醋酸溶液其浓度大于0.01mol/L,H2SO4是强酸,能完全电离,pH=2的H2SO4溶液的物质的量浓度为0.005mol/L,比值大于2:1,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
微粒
| H+
| OH-
| CH3COO-
| CH3COOH
|
物质的量浓度
| 增大
| 减小
| 减小
| 增大
|
则X物质可能为? (? )
A.氯化氢
B.氢氧化钠
C.蒸馏水
D.醋酸
参考答案:A
本题解析:略
本题难度:一般
4、选择题 在0.1mol·L-1氨水中加入少量的NH4Cl晶体,则溶液的pH
A.变大
B.变小
C.不变
D.无法确定