微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列表格中的各种情况,可以用下面对应选项中的图象曲线表示的是( )
| 选项 | 反应 | 纵坐标 | 甲 | 乙
A
外形、大小相近的金属和水反应 | 反应速率
Mg
Na
B
4mL?0.01mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2mL反应
0.1mol/L的H2C2O4溶液
0.2mol/L的H2C2O4溶液
C
5mL?0.1mol/L?Na2S2O3溶液和5mL?0.1mol/L?H2SO4溶液反应
热水
冷水
D
5mL?4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
|
A.

B.
C.
D.
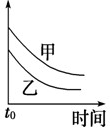
参考答案:A.Na比Mg活泼,反应速率快,则图象中乙应在上方,故A错误;
B.浓度大,反应速率快,则图象中乙应在上方,故B错误;
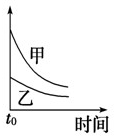
C.温度高,反应速率快,随反应的进行,正反应速率逐渐减小,甲的温度高,图中中应在上方,与图象一致,故C正确;
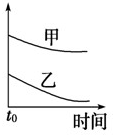
D.加催化剂,反应速率加快,则图中应乙在上上,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)  ?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
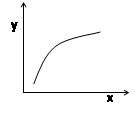
A.若平衡常数K值变大,平衡移动时v逆先减小后增大
B.容器中固体物质的质量不再改变,则反应到达平衡状态
C.若x表示温度,y可表示平衡时混合气体的密度
D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比
参考答案:BC
本题解析:该反应为正方向体积增加且吸热,A.若平衡常数K值变大,平衡右移,v逆增大,错误;B.容器中固体物质的质量不再改变,说明生成量和消耗量相等,则反应到达平衡状态,正确;C、升高温度,平衡正向移动,气体的质量增加,密度增大,正确;增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故D错误;
本题难度:一般
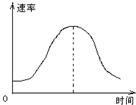
3、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示.在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度.影响反应速率的因素是( )
A.①④
B.③④
C.①②③
D.②③