微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铁和铁的化合物用途广泛.请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:______.
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______.
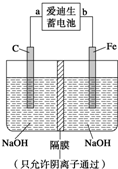
(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
①爱迪生蓄电池的正极是______,该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______.
②高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式______.
③你认为高铁酸钠作为一种新型净水剂的理由错误的是______.
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为______.
参考答案:(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子O2+4e-+2H2O=4OH-,负极上铁失电子发生氧化反应,正极上发生的反应为O2+4e-+2H2O=4OH-,二价铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,氢氧化铁失去部分水生成铁锈,所以铁锈的成分是Fe2O3?xH2O,氧化铁和稀硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+═2Fe3++3H2O,铁和铁离子能发生氧化还原反应生成亚铁离子2Fe3++Fe=3Fe2+,导致溶液中不存在铁离子,
故答案为:O2+4e-+2H2O=4OH-;Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)①放电时,镍元素的化合价由+4价变为+2价,所以NiO2作正极,充电时,铁电极上氢氧化亚铁得电子发生还原反应生成铁,
故答案为:NiO2;还原反应;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,故选ad;
(3)设Fe2+与Fe3+物质的量分别为x、y,根据铁原子、氧原子守恒得(x+y):(x+1.5y)=4:5,x=y,所以x:y=1:1,故答案为:1:1.
本题解析:
本题难度:一般
2、简答题 如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.
(1)As(砷)位于元素周期表中第四周期VA族,则Na3AsO4溶液的pH______(填“>7”“<7”“=7”).
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移.此时A杯中的主要实验现象是______,D电极上的电极反应式为______.
(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移.
此时整套实验装置的总的离子方程式为______.
(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=______.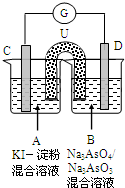
参考答案:(1)As(砷)位于元素周期表中第四周期VA族,联想到同族元素相似性,磷酸根离子水解时溶液显碱性,故神酸根离子水解,溶液显碱性,故PH>7,故答案为:>7;
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移,“G是灵敏电流计,其指针总是偏向电源正极”所以所以说电子从C跑到D,即碘离子发生氧化反应,失去电子,生成碘单质遇到淀粉变蓝,是浓硫酸将低价的亚砷酸根离子氧化,该离子发生还原反应,实质是:AsO43-+2H++2e-=AsO32-+H2O,故答案为:无色溶变为蓝色;AsO43-+2H++2e-=AsO32-+H2O;
(3)再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明C是正极,D是负极,A中发生碘单质失电子的反应,B中发生亚砷酸失电子的反应,总反应为:AsO32-+I2+2H2O=2H++2I-+AsO43-,故答案为:AsO32-+I2+2H2O=2H++2I-+AsO43-;
(4)根据反应AsO32-+I2+2H2O=2H++2I-+AsO43-,该反应的化学平衡常数的表达式为:K=[H+]2?[I-]2?[AsO43-][I2]?[AsO33-],故答案为::[H+]2?[I-]2?[AsO43-][I2]?[AsO33-].
本题解析:
本题难度:一般
3、选择题 关于下列各装置图的叙述中,正确的是( )
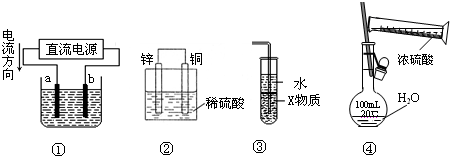
A.若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
D.装置④可用于实验室配置一定物质的量浓度的稀硫酸
参考答案:A、装置中电流方向可知,a为阳极,精炼铜时需要粗铜做阳极a,故A错误;
B、装置形成的是铜锌原电池,锌做负极发生氧化反应,故B错误;
C、氨气不溶于四氯化碳,极易溶于水,装置可以起到防倒吸,同时吸收氨气的作用,故C正确;
D、容量瓶是精密量具,浓硫酸溶于水温度升高,不能在容量瓶中溶解,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜电极上发生氧化反应
B.电解饱和食盐水制烧碱时,用铜作阳极
C.电解法精炼铜时,粗铜连接电源的正极
D.电镀铜和精炼铜时,均用纯铜作阴极
参考答案:A.原电池中活泼金属作负极,则Cu为正极,所以铜锌原电池中铜电极上发生还原反应,故A错误;
B.电解饱和食盐水制烧碱时,应采用惰性电极,若采用Cu为阳极,则生成氢氧化铜,故B错误;
C.粗铜精炼中,粗铜作阳极,所以电解法精炼铜时,粗铜连接电源的正极,故C正确;
D.电镀铜时,纯铜为阳极,在阳极上失去电子,精炼铜时,纯铜为阴极,在阴极上铜离子得电子,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 某可充电电池的原理如下图所示,已知a、b为惰性电极,溶液 呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A.充电时,b极接直流电源正极,a极接直流电源负极
B.充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
C.放电时,H+从左槽迁移进右槽
D.放电过程中,左槽溶液颜色由黄色变为蓝色