| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《电解池原理》试题巩固(2017年最新版)(八)
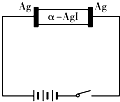 参考答案:因阳极和阴极都是银极,阳极电极反应为Ag-e-═Ag+,阴极电极反应为Ag++e-═Ag,则α-AgI是Ag+导电,则通电一段时间后晶体质量不变,若是碘离子导电,固体密度减小; 本题解析: 本题难度:简单 4、选择题 用石墨做电极电解CuCl2溶液,下列判断正确的是 参考答案:D 本题解析:在电解池中阴极得到电子,发生还原反应。阳极失去电子,发生氧化反应。所以用石墨做电极电解CuCl2溶液时,阳极氯离子放电,生成氯气。阴极铜离子放电析出铜。所以正确的答案是D。 本题难度:一般 5、简答题 二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。 参考答案:(1)2H2(g)+3CO(g)=CH3OCH3(g)+CO2(g) ?△H=-246.4 kJ·mol-1 本题解析:(1)由盖斯定律可知,工业上用水煤气按1:1合成二甲醚的热化学方程式是, 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《电解池原理.. | |