微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (共12分)某同学利用以下装置制备氨气并探究氨气的还原性。
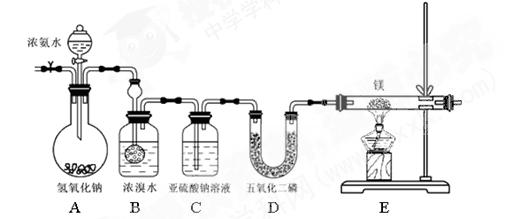
实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为?(用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式?
(3)亚硫酸钠的作用?
(4)此装置有不足之处,请说明?
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式?
参考答案:(共12分)
(1)①氢氧化钠溶水放热,降低氨的溶解度②溶液中含有大量的OH-,使NH3+H2O
NH3H2O OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)
OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)
(2)3Br2+8NH3=6NH4Br+N2(或3Br2+2NH3=6HBr+N2)?(2分)
(3)除去氮气中混有的溴(除去少量的氨气)?(1分)
(4)空气中的水进入E装置,遇氮化镁生成氨气,污染环境。(C中可能发生倒吸现象,应该防倒吸)?(2分)
(5)Mg3N2+8HCl=3MgCl2+2NH4Cl , Mg+2HCl=MgCl2 +H2↑?(4分)
本题解析:略
本题难度:一般
2、选择题 工业上用洗净的废铜屑作原料来制备硝酸铜,为节约原料和防止环境污染,宜采用的方法是
A.Cu+HNO3(稀) Cu(NO3)2
Cu(NO3)2
B.Cu+HNO3(浓) Cu(NO3)2
Cu(NO3)2
C.Cu CuSO4
CuSO4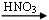 Cu(NO3)2
Cu(NO3)2
D.Cu CuO
CuO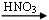 Cu(NO3)2
Cu(NO3)2
参考答案:D
本题解析:A、B、C选项都能产生有毒的气体,污染环境,D不产生有毒气体,也节约原料
故选D。
本题难度:一般
3、选择题 下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是
[? ]
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸 ⑦AgNO3溶液与氨水
A.除③外
B.除③⑦外
C.除③④外
D.除⑥⑦外
参考答案:C
本题解析:
本题难度:简单
4、实验题 (16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为?mol。
(2)测定NO的体积
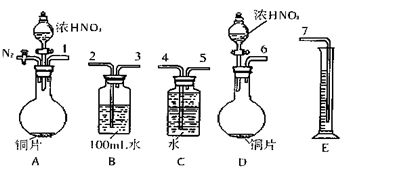
①从上图所示的装置中,你认为应选用?装置进行Cu与浓硝酸反应实验,选用的理由是?。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号)?。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
?(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中?(填“有”或“没有”)NO产生,作此判断的依据是?。
(4)实验前,用托盘天平称取的铜片至少应为??g。
参考答案:(1)0.008(2分)
(2)A(2分,因为A装置可以通N2装装置中的空气排尽,防止反应生成的NO被装置内空气中O2氧化(2分)
②123547(2分,若只填出“1547”给1分)?③升高(2分)
(3)有(2分)
因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6mL<112.0mL)(2分)
(4)0.5(2分)
本题解析:(1)NaOH+HNO3=NaNO3+H2O
1? 1
则:c(NaOH)V(NaOH)=n(HNO3),带入数据,得:
n(HNO3)=4×0.1mol·L-1×(20.40-0.40)×10-3L=0.008mol
(2) ②A中生成的气体可能有NO、NO2,通过B(3 NO2+H2O=2HNO3+NO)将NO2转化为NO,再通过C排水到E中,E中测得水的体积即为NO体积;
③若量筒中水的液面比集气瓶的液面要低,说明装置内气压小于外界气压,所以应将量筒的位置升高,以保证量筒中的液面与集气瓶中的液面持平;
(3)3 NO2+H2O=2HNO3+NO,由(1)知:n(HNO3)= 0.008mol
2? 1
0.008mol 0.004mol
V(NO)= 0.004mol×22.4mol.L-1=89.6mL
即:NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6mL<112.0mL)
(4) (4)由(3),得:n(NO2)=0.012mol,
反应中生成的n(NO)=(0.112-0.0896)L/22.4L·mol-1=0.001mol
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O? 3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O
1? 2? 3? 2
0.006mol?0.012mol? 0.0015mol? 0.001mol
则n(Cu)= 0.006mol +0.0015mol="0.0075" mol,
所以:m(Cu)=" 0.0075" mol×64g·mol-1=0.48g,≈0.5g
本题难度:一般
5、选择题 38.4g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体22.4L(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0mol
B.1.6 mol
C.2.2 mol
D.2.4 mol
参考答案:C
本题解析:略
本题难度:一般