微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某元素氢化物的化学式为RH3,在R的最高价氧化物中氧的质量分数为56.3%,则R的相对原子质量为________,R元素在周期表中的位置为________周期________族。
参考答案:31? 3?ⅤA
本题解析:根据RH3得R的最高正价为+5,则最高价氧化物的化学式为R2O5,根据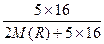 ×100%=56.3%,求出M(R)=31,所以为磷元素,位于3周期VA族。
×100%=56.3%,求出M(R)=31,所以为磷元素,位于3周期VA族。
本题难度:简单
2、选择题 工业制取硝酸的尾气含有NO2,NO,通常用NaOH吸收:
NO+NO2+2NaOH=2 Na NO2+H2O
2 NO2+2NaOH=Na NO2+Na NO3+H2O
NO2与NO体积比为下列值时,不能被完全吸收的是
A.1∶1 
B.1∶3
C.3∶1
D.2∶1
参考答案:B
本题解析:略
本题难度:一般
3、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。
参考答案:
(1)
(2)436.1kJ/mol
(3)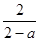
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题解析:(1)氨气催化氧化的化学方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2? H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3
2NH3
起始? n? 3n? 0
转化 na? 3na? 2na
平衡n(1-a) 3n(1-a)? 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题难度:一般
4、选择题 在一定条件下,将集满二氧化氮气体的试管倒立在盛水的水槽中,与水充分作用后,剩余气体的体积变成原气体体积的(?)
A.1/2
B.2/3
C.1/3
D.3/8
参考答案:C?
本题解析:二氧化氮遇水发生反应:3NO2+H2O===2HNO3+NO
本题难度:一般
5、计算题 在标准状况下,560体积氨气溶解在1体积的水中,求制得氨水中溶质的质量分数。若制得氨水的密度为0.91 g·cm-3,求氨水的物质的量浓度。
参考答案:氨水中溶质的质量分数为29.8%;溶液的物质的量浓度为15.95 mol·L-1。
同步测验
本题解析:有关氨水浓度的计算,首先应明确溶质是氨分子。
标准状况下560体积的氨可以假定体积为560 L,便于计算。560 L除以22.4 L·mol-1即得到氨的物质的量,再乘以氨的摩尔质量便求出溶质的质量。溶质质量加上1 L水的质量即为溶液质量。
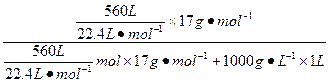 ×100%=29.8%
×100%=29.8%
知道氨水密度,再根据氨水的溶质质量分数便可以求出氨水的物质的量浓度。
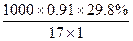 ?mol·L-1="15.95" mol·L-1
?mol·L-1="15.95" mol·L-1
本题难度:简单