微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
参考答案:(1)2s22p3 ;NH4NO3?或?NH4NO2(合理给分)?(2分)
(2)5; 原子?(2分)
(3)Si、 Cl ; 氢化物稳定性或最高价氧化物对应水化物酸性 (2分)
(4)三角锥形 ; C2H6? (合理给分)(2分)
(5)3.5 ; 4NA(NA代表阿伏伽德罗常数 )或2.408×1024 (2分)
(6)< ;N2H62+ +2H2O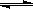 N2H4·2H2O+2H+(合理给分)(2分)
N2H4·2H2O+2H+(合理给分)(2分)
本题解析:(1)氮原子是7号元素,最外层电子排布式为2s22p3;2种价态氮的化合物的化学式NH4NO3?或?NH4NO2。
(2)硅原子是14号元素,核外电子排布式为1S22s22p6 3S23P2能层和能级其中任一项不同,即轨道能量不同,故核外电子排布在5种不同能量的电子亚层上,氮化硅是一种超硬物质据此性质可知氮化硅属于原子晶体。
(3)上述反应中,属于同一周期的元素符号有Si、 Cl ; ,用氢化物稳定性或最高价氧化物对应水化物酸性事实可以比较它们的非金属性强弱。
(4)NH3分子中氮原子发生了SP3杂化,但配位原子只有3个,故其空间构型是三角锥形;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是 C2H6。
(5)N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ反应中有4mol N-H键断裂,即有1molN2H4发生了反应,则形成的气体有3.5mol,其中转移电子数目 4NA。
(6)硫酸铵是强酸弱碱盐,可知该物质也是,则其溶液PH小于7,水解方程式可写为N2H62+ +2H2O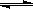 N2H4·2H2O+2H+。
N2H4·2H2O+2H+。
本题难度:一般
2、实验题 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净的氮气。反应方程式为
NaNO2+NH4Cl====NaCl+N2↑+2H2O(正反应放热)
如下图所示

(1)装置中,A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是______________(填写编号)。
a.防止NaNO2饱和溶液蒸发? b.保证实验装置不漏气? c.使NaNO2饱和溶液顺利滴下
(2)B部分的作用是_______________________。
a.冷疑? b.冷却氮气? c.缓冲氮气流
(3)加药品前必须进行的一个操作步骤是____________;加热片刻后即应移去酒精灯以防止反应物冲出,其原因是____________________________。
(4)收集N2前,必须进行的步骤是(用文字说明)__________________;收集N2最适宜的方法是(填写编号)______________。
a.用排气法收集在集气瓶中? b.用排水法收集在集气瓶中? c.直接收集在球胆或塑料袋中
参考答案:(1)c?(2)a?(3)检验装置的气密性?本反应为放热反应?(4)将系统内空气排尽? c
本题解析:本题情景新颖,需要仔细读题、审题,并抓住以下几点认真分析才能得出答案。①装置图。②产生的气体。③反应的热效应。④制取纯净氮气。⑤合成氨的反应物比例及反应的可逆性。
(1)反应产生气体,分液漏斗与蒸馏烧瓶之间若无导管连接,则烧瓶中气体的压强就会比分液漏斗中大,分液漏斗中的液体就不容易滴下;若有导管连接,则烧瓶和分液漏斗中气体的压强相同,分液漏斗中的液体能够顺利滴入烧瓶中。
(2)由于是溶液中的反应,且反应需要加热,生成物氮气中必然有水蒸气。通过冰盐制冷剂,可将大部分水蒸气冷凝。
(3)制气反应发生前,必须检验装置的气密性。
该反应是放热反应,反应放出的热量能够维持反应的继续进行,故反应发生后,就不需要再加热,否则会由于反应过于激烈,而使气体的收集难于控制。
(4)因为要收集纯净的氮气,所以a、b不可取。由于系统内原先充满空气,所以收集氮气前,还需将装置内的空气排净。
本题难度:简单
3、计算题 在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为?(用只含c的代数式表示)。
(2)填表。
表达要求
| 只含b的代数式
| 只含c的代数式
|
a的取值范围
| ?
| ?
|
?
(3)写出只含c的代数式的推导过程。
参考答案:(1)4c/3或1.33c(2分)(带单位扣1分)
b<a<3b(2分)(若有取等号扣1分,后同); 4c/3<a<4c或1.33c<a<4c
(3)2分。(说理或推导充分即可。可用方程式推导;也可用得失电子守恒推导。)
本题解析:(1)NO2溶于水生成硝酸和NO,反应的方程式为3NO+H2O=2HNO3+NO,因此bL气体是NO。通入氧气后NO转化为稀硝酸,反应的方程式为
4NO+3O2+2H2O=4HNO3
4? 3
b? c
即4:3=b:c
解得b=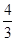 c
c
(2)如果混合气全部是NO2,则根据方程式3NO+H2O=2HNO3+NO可知生成NO的体积是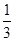 a,b=
a,b=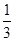 a;如果全部是NO,则生成b=a,所以
a;如果全部是NO,则生成b=a,所以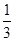 a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=
a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=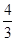 c,所以如果只用含c的代数式表示,则a的取值范围是
c,所以如果只用含c的代数式表示,则a的取值范围是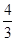 c<a<4c。
c<a<4c。
(3)如果混合气全部是NO2,反应中氮元素的化合价从+4价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知a=4c;如果全部是NO,反应中氮元素的化合价从+2价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知3a=4c,所以a的取值范围是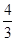 c<a<4c。2、NO与水以及氧气反应的有关计算
c<a<4c。2、NO与水以及氧气反应的有关计算
本题难度:一般
4、实验题 如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法?。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
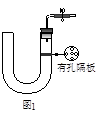
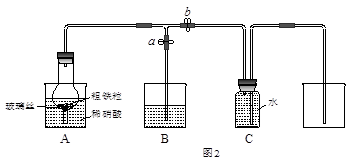
(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、 91eXAm.org烧杯、?。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是?。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤
| 操作
| 现象与结论
|
第一步
| 取少量液体装于试管,向试管中滴入几滴KSCN溶液。
| ?
|
第二步
| ?
| 若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
|
?
参考答案:(1)关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好(没有关闭止水夹不得分)(2分)
(2)不溶于水的块状固体,不需要加热(2分)
(3)2.95mol·L-1(2分,没单位不得分)?
500mL容量瓶、胶头滴管(2分,各1分,其中500mL容量瓶只答容量瓶不给分)
(4)铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体(2分,只要答出红棕色气体即给2分)?吸收二氧化氮(2分)
(5)若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+(1分)
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液(1分)
本题解析:(1)利用气体压强来检验装置的气密性,具体操作:关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好
(2)图1相当于简易启普发生器装置,可适用的反应条件和反应物状态为不溶于水的块状固体,不需要加热
(3)利用溶液中溶质质量分数与物质的量浓度的换算关系,得稀硝酸的物质的量浓度为1000ml·L-1×1.10 g·cm-3×16.9%/63g·mol-1=2.95mol·L-1,配制500ml的溶液还需500mL容量瓶、胶头滴管
(4)装置中存在空气,所以实验开始时看到A中铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体,B装置中液体的作用是除去二氧化氮气体
(5)铁元素的价态一般为+2、+3,加入KSCN溶液,若有溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;紫色溶液为高锰酸钾溶液,所以第二步中操作为取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液
本题难度:困难
5、实验题 为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出现沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中同学所选的试剂A不合理,理由是________________。
(2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码,烧杯、过滤器、铁架台及附件,胶头滴管、量筒,其中还缺少一件必备的仪器是_____________。
②若过滤所得沉淀未经洗涤烘干称量,测得结果将________(填“偏高”或“偏低”)。
③若实验测得混合物的质量为W g,沉淀物的质量为m g,实验测定的氯化铵质量分数计算式=_____________。
参考答案:(1)甲因为AgNO3既可以与NH4Cl反应生成AgCl白色沉淀,又可与(NH4)2SO4反应生成微溶于水的Ag2SO4,达不到实验目的
(2)①玻璃棒?②偏低
③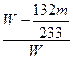 ×100%
×100%
本题解析:(1)甲同学选用试剂A是错的,因为AgNO3既可以与NH4Cl反应生成AgCl白色沉淀,又可与(NH4)2SO4反应生成微溶于水的Ag2SO4,达不到实验目的。
(2)①玻璃棒,溶解、洗涤、过滤等各步均需使用玻璃棒。
②未经洗涤、烘干就称量,使得称量数值比实际数值大,造成求出的NH4Cl质量分数偏低。
③(NH4)2SO4+BaCl2====BaSO4↓+2NH4Cl
132? 233
x?m g
x= g
g
w(NH4Cl)=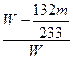 ×100%
×100%
本题难度:简单