微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知热化学方程式:SO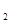 (g)+1/2O
(g)+1/2O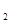 (g)
(g) SO
SO (g)△H=-98.32kJ/mol,现有4molSO
(g)△H=-98.32kJ/mol,现有4molSO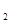 参加反应,当放出314.3kJ热量时,SO
参加反应,当放出314.3kJ热量时,SO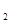 的转化率最接近于
的转化率最接近于
A.40%
B.50%
C.80%
D.90%
参考答案:C
本题解析:1mol SO2完全反应放出98.32kJ的热量,当放出314.3kJ的热量时反应了3.2mol SO2,所以SO2的转化率是80%。答案选C。
点评:可逆反应中的反应热,是指反应物完全反应生成产物的能量变化。
本题难度:一般
2、选择题 反应4NH3+5O2=4NO+6H2O,在2L的密闭容器中进行,半分钟后NO的物质的量增加了3.0mol,则此反应的平均速率v(X)为
[? ]
A.?v(O2)=?0.1mol·(L·s)-1?
B.?v(NO)=?0.05?mol·(L·s)-1
C.?v(H2O)=0.075?mol·(L·s)-1?
D.?v(NH3)=0.025?mol·(L·s)-1
参考答案:BC
本题解析:
本题难度:简单
3、选择题 下列事实不能用勒沙特列原理解释的是(? )
A.氨水应密闭保存,放置低温处
B.在FeC12溶液中加入铁粉防止氧化变质
C.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
D.实验室可用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:勒沙特列原理为平衡移动原理,在使用勒沙特列原理时,反应必须是可逆反应存在平衡移动,且移动方向符合勒沙特列原理。A、氨水中存在平衡:NH3 + H2O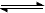 NH3·H2O
NH3·H2O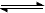 NH4+ + OH-,温度升高,一水合氨易分解,平衡左移,应密闭保存,放置低温处,能用勒沙特列原理解释,错误;B、在FeC12溶液中加入铁粉防止氧化变质,反应为:2Fe3++Fe═3Fe2+,不是可逆反应,不能利用勒沙特列原理解释,正确;C、醋酸溶液中存在:CH3COOH
NH4+ + OH-,温度升高,一水合氨易分解,平衡左移,应密闭保存,放置低温处,能用勒沙特列原理解释,错误;B、在FeC12溶液中加入铁粉防止氧化变质,反应为:2Fe3++Fe═3Fe2+,不是可逆反应,不能利用勒沙特列原理解释,正确;C、醋酸溶液中存在:CH3COOH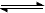 CH3COO—+H+,加水稀释,促进电离,常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5,能用勒沙特列原理解释,错误;D、氯水中存在平衡:Cl2+H2O
CH3COO—+H+,加水稀释,促进电离,常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5,能用勒沙特列原理解释,错误;D、氯水中存在平衡:Cl2+H2O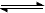 HCl +HClO,饱和食盐水中含有大量氯离子,抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,错误。
HCl +HClO,饱和食盐水中含有大量氯离子,抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,错误。
本题难度:一般
4、选择题 对于x A(g) + y B(g) 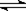 ?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
A.x+y>z+w ,正反应是放热反应
B.x+y>z+w ,正反应是吸热反应
C.x+y<z+w ,逆反应是放热反应
D.x+y>z+w ,逆反应是吸热反应
参考答案:B
本题解析:如果正反应是放热反应,则升高温度,平衡向逆反应方向移动。要使体系的压强降低,则气体的体积应该是减小的,即正反应使体积增大的,所以选项A、D不正确;如果正反应是吸热反应,则升高温度,平衡向正反应方向进行,则正反应一定是体积减小的,选项B正确,C不正确,所以答案选B。
本题难度:一般
5、选择题 已知在550℃时,一定容积的容器中发生反应:2SO2+O2 ?2SO3(正反应放热),判断该反应达到平衡状态的标志是
?2SO3(正反应放热),判断该反应达到平衡状态的标志是
A.SO2和SO3浓度相等
B.SO3的生成速率与SO2的消耗速率相等
C.容器中气体的压强不变
D.容器中混合气体的密度保持不变
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度和含量均不再发生变化的状态,把这种状态称为化学平衡状态。A中浓度相等,但正逆反应速率不一定相等,不能说明。B中反应速率的方向是相同的,所以不能说明。反应前后气体的体积是变化的,所以压强也是变化的,因此当压强不再发生变化时,反应即达到平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中,气体质量和容积均是不变的,所以密度始终是不变的,答案选C。
本题难度:一般