微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)(1)在一定温度下,向1L体积固定的密闭容器中加入1mol A(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= ?. 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时?是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= ?. 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时?是原来的2倍。
a.平衡常数? b. A的平衡浓度?
c.平衡时混合气体的密度? d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡??移动(填“向左”“向右”或“不”);若加入少量下列试剂中的??,产生H2的速率将增大。
a.NaNO3? b.CuSO4 ?
c.Na2SO4?d.NaHSO3?
e.? CH3COOH?
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)已知:2Zn(s)+O2(g)=2ZnO(s)?△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)?△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)?△H=_____________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
参考答案:(共14分)(1)0.1mol/(L·min) ; b c (2)向右?; b
(3)4a NA?(4)-259.7 kJ·mol-1?(5)6
本题解析:(1)在0—2min内B增加了0.1mol,则根据反应式A减少了0.2mol,所以起反应速率是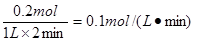 。由于反应前后体积不变,所以若开始加入A(g)的物质的量是原来的2倍,则平衡时A的平衡浓度和平衡时混合气体的密度都是原来的2倍,ac都是不变的,答案选bc。
。由于反应前后体积不变,所以若开始加入A(g)的物质的量是原来的2倍,则平衡时A的平衡浓度和平衡时混合气体的密度都是原来的2倍,ac都是不变的,答案选bc。
(2)锌和稀硫酸反应生成氢气,则溶液中氢离子的浓度降低,所以水的电离平衡向正反应方向移动,即向右移动。b可以构成铜锌原电池,加快反应速率。a中不再产生氢气,b不影响,d会消耗氢离子,近似反应速率。醋酸是弱酸,不能增大氢离子的浓度,答案选b。
(3)入a mol 的Cu(OH)2可使溶液恢复原状,说明在反应中阴极还产生氢气,但阳极始终是OH-放电产生氧气。a mol Cu(OH)2中含有2amol氧原子,所以反应中转移的电子是2amol×2=4amol。
(4)考查盖斯定律的应用,(①-②)÷2即得到Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),所以反应热是(-701.0kJ·mol-1+181.6kJ·mol-1)÷2=-259.7 kJ·mol-1.
(5)根据溶度积常数的表达式可知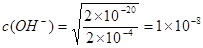 ,则氢离子浓度是
,则氢离子浓度是 ,所以pH=6.
,所以pH=6.
本题难度:一般
2、选择题 一定条件下,在体积为10L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)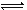 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(? )
Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(? )
A.60s里以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的DH>0
参考答案:A
本题解析:经60s达到平衡,生成0.3 mol Z,所以用Z表示的反应速率为
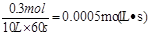 。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
本题难度:简单
3、计算题 (10分)已知几种共价键的键能数据如下:
共价键
| N≡N
| H-H
| N-H
|
键能/(kJ·mol-1)
| 946
| 436
| 390.8
|
⑴通过计算,写出合成氨反应的热化学方程式。
⑵某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率和该温度下的化学平衡常数。
参考答案:⑴N2(g)+3H2(g) 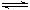 2NH3(g)? ΔH=-90.8 kJ·mol—1
2NH3(g)? ΔH=-90.8 kJ·mol—1
⑵N2的转化率为75%?K="256/3" (或85.3)
本题解析:略
本题难度:一般
4、计算题 现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)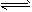 2SO3(g) 已知c(SO2)始=0.4mol/L,
2SO3(g) 已知c(SO2)始=0.4mol/L,
c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时,SO2的转化率应为多少?
参考答案:“略”
本题解析:
本题难度:一般
5、选择题 反应:A(g)+3B(g) 2C(g);ΔH<0,达平衡后,将气体温度降低,下列叙述中正确的是(?)
2C(g);ΔH<0,达平衡后,将气体温度降低,下列叙述中正确的是(?)
A.v(正)加大,v(逆)减小,平衡右移
B.v(正)、v(逆)都减小,平衡右移
C.v(正)、v(逆)都加大,平衡左移
D.v(正)、v(逆)都减小,平衡左移
参考答案:B
本题解析:降低浓度,v(正)、v(逆)都减小,因v(正)是放热反应,降温,平衡向放热方向移动。
本题难度:一般