微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求:
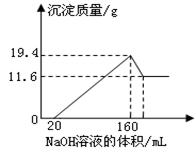
(1)19.4g沉淀中含有Al(OH)3的质量;
(2)当Al(OH)3完全溶解时所加入的NaOH溶液的体积为?;
(3)盐酸的物质的量浓度。
参考答案::(1)19.4-11.6=7.8g
(2) 180ml
(3)8mol/L
本题解析:
解:设镁的物质的量为x,铝的物质的量为y;过量HCl的物质的量为n。
(1)根据图可知:Mg(OH)2的质量为11.6g,Al(OH)3的质量为(19.4-11.6)g==7.8g
(2)设Al(OH)3完全溶解时消耗的NaOH物质的量为z,
Al(OH)3?+ NaOH = NaAlO2 + 2H2O
1mol? 1mol
7.8/78? z
z = 0.1mol
V(NaOH)=0.1/5=0.02L?即20ml。
当Al(OH)3完全溶解时所加入的NaOH溶液的体积为160+20=180ml。
(3)Mg + 2HCl ="=" MgCl2+H2↑? 2Al + 6HCl ="=" 2AlCl3+3H2↑?
1mol ? 2mol? 1mol? 2mol? 6mol? 2mol
x? 2x? x? y? 3y? y
MgCl2+2NaOH==Mg(OH)2↓+2NaCl? AlCl3+3NaOH==Al(OH)3↓+3NaCl
1mol? 58g? 1mol? 78g
x? 11.6g? y? 7.8g
∴x==0.2mol,y==0.1mol
HCl?+? NaOH ="=" NaCl+H2O
1mol? 1mol
n? 5.0mol/L×0.02L? n==0.1mol
根据Cl守恒:
∴C(HCl)==(2×0.2mol+3×0.1mol+0.1mol)÷0.1L==8mol/L
点评:本题考查化学反应与图象的关系,明确图象中坐标及点、线、面的意义,明确发生的化学反应是解答本题的关键,注意氢氧化铝能溶于碱,而氢氧化镁不能。
本题难度:一般
2、填空题 (12分)O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____ ,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________ (用含NA的式子表示)。
参考答案:(1)3:2 1:1 (2)1:1 2:3 2:3 (3)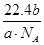 L
L
本题解析:(1)设其质量为m,等质量的O2和O3所含分子个数比=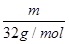 NA:
NA: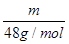 NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
(2)温同压下,气体摩尔体积相同,根据N=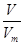 NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=
NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=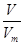 M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
(3)氧气的摩尔质量为M=m÷n=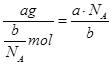 g/mol,则c g O2在标准状况下体积为:V=
g/mol,则c g O2在标准状况下体积为:V=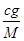 ?Vm=
?Vm=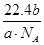 L。
L。
考点:考查常用化学计量数计算、阿伏伽德罗定律及推论
本题难度:一般
3、实验题 18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
参考答案:(1) 11.1 (2) 浓硫酸 、 水
(3) 100mL容量瓶 (6)① 偏低 ② 偏高 ③ 无影响
本题解析:(1)稀释过程中溶质不变,所以浓硫酸的体积是
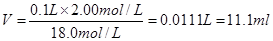 。
。
(2)浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的。所以稀释浓硫酸应该是将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中。
(3)准确配制一定物质的量浓度溶液时,需要用相应规格的容量瓶。
(6)误差分析主要时依据c=n/V。
①没有洗涤,则溶质偏少,浓度偏低。
②定容时俯视读数,则容量瓶中溶液的体积偏少,浓度偏高。
③由于需要用蒸馏水定容,所以容量瓶中含有蒸馏水对结果是不影响的。
本题难度:一般
4、选择题 有下列物质:①0.5mol  NH3? ②标准状况下22.4L He? ③4℃时9ml H2O? ④0.2mo
NH3? ②标准状况下22.4L He? ③4℃时9ml H2O? ④0.2mo l H3PO4。按所含的原子数由多到少的顺序排列正确的是? (?)
l H3PO4。按所含的原子数由多到少的顺序排列正确的是? (?)
A.①④③②
B.④③②①
C.②③④①
D.①②③④
参考答案:A
本题解析:略
本题难度:一般
5、选择题 在标准状况下,4个等体积的干燥圆底烧瓶中分别充满①NH3,②混有少量空气的HCl,③NO2,④以体积比4:1混合的NO2和O2的混合气,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度比为( )
A.1:1:1:1
B.3:3:2:3
C.5:5:5:4
D.无法确定
参考答案:C
本题解析:①中可假设烧瓶容积为2.24L。2.24LNH3的物质的量为0.1mol,所得溶液体积为2.24L,所以物质的量浓度为
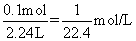
②类似可设混合气体中有HCl体积为2.24L,空气0.26L,烧瓶容积为2.5L。可想像烧瓶由两部分组成,一部分为0.26L装有空气,另一部分为2.24L装有HCl,空气不溶液于,则HCl溶解后的结果与A相同。
③可设有3LNO2,烧瓶的容积为3L,则所得溶液的体积的2L,溶液中含溶质2/22.4mol,去除溶液的体积2L,所得溶液中溶质的物质的量浓度与AB相同。 ④可设气体由4LNO2与1LO2组成,溶于水后所得溶液的体积为5L,溶质为4/22.4mol,除以溶液的体积5L,所得溶液中溶质的物质的量浓度为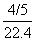 mol/L。
mol/L。
本题难度:简单