微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
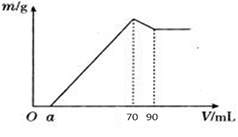
请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
参考答案:(1)3.5 mol?L-1 (2)5.4 mL 85% 3%
本题解析:Oa段意味着H2SO4过量,到70 mL时的沉淀最多,有Al(OH)3、Fe(OH)3沉淀,到90 mL时仅剩下Fe(OH)3沉淀。加入20 mL、10 mol·L-1 NaOH,把Al(OH)3↓全部转化成AlO2- 。(1)70 mL时沉淀最多,溶液为Na2SO4溶液,据电荷守恒,n(Na+)=2n(SO42- )。又据元素守恒,n(Na+)="n(NaOH)=10" mol·L-1×0.07 L="0.7" mol,n(SO42-)=n(H2SO4 )=c(H2SO4 )×0.1,所以c(H2SO4 )=3.5 mol?L-1
(2)沉淀Al3+消耗OH-的量,是使Al(OH)3溶解消耗OH-的3倍,即沉淀Al3+消耗NaOH为60 mL,若a=4.6,用于沉淀Fe3+消耗NaOH的体积是70-60-4.6="5.4" mL.
n(Al2O3 )="1/2n(NaOH)=1/2×(10" mol·L-1×0.02 L)="0.1" mol m(Al2O3 )="0.1" mol×102 g/mol="10.2" g
Al2O3的质量分数为=10.2/12×100%=85%,沉淀铁离子消耗NaOH的物质的量为10×0.0054=0.054moL,根据Fe3++3OH-=Fe(OH)3,铁离子的物质的量为0.018moL,Fe2O3的质量分数为[(0.009×160)÷12]×100%=12%,SiO2的质量分数为3%。
考点:考查铝、铁及其化合物的有关计算。
本题难度:一般
2、选择题 将5 mL物质的量浓度为18.4 mol·L-1的浓硫酸加入水中,稀释成100 mL溶液,所得稀硫酸的物质的量浓度为(? )
A.0.46 mol·L-1
B.0.92 mol·L-1
C.4.6 mol·L-1
D.5 mol·L-1
参考答案:B
本题解析:c(稀H2SO4)="5" mL×18.4 mol·L-1÷100 mL="0.92" mol·L-1。
本题难度:简单
3、选择题 100mL0.3mol/L硫酸和50mL0.6mol/L硫酸混合后,混合溶液中硫酸的物质的量浓度为(假设混合溶液的体积等于被混合液体积之和)( )
A.0.3mol/L
B.0.45mol/L
C.0.4mol/L
D.0.6mol/L
参考答案:100mL 0.3mol/L 硫酸和50mL 0.6mol/L 硫酸混合后,n(H2SO4)总=0.1L×0.3mol/L+0.05L×0.6mol/L=0.06mol,
c(H2SO4)总=0.06mol0.15L=0.4mol/L.
故选C.
本题解析:
本题难度:简单
4、选择题 取1 mol乳酸均匀分成两份,一份加入足量的烧碱溶液,另一份加入足量的金属钠,则两份乳酸消耗NaOH和Na的物质的量分别为? ( ? )
A.1 mol和1 mol
B.2 mol和1 mol
C.1 mol和2 mol
D.0. 5 mol和1 mol
参考答案:C
本题解析:乳酸结构简式为?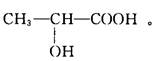
本题难度:一般
5、填空题 实验室制取0.5mol/L的NaCl溶液500mL,有以下仪器:
①烧杯②100mL量筒③1000mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有______(填序号),还缺少的仪器是______.
(2)实验两次用到玻璃棒,其作用分别是______、______.
(3)配制时,一般可分为以下几个步骤:
①称量:在天平上称量______gNaCl,放入烧杯中,加水溶解,冷却至室温
②把制得的溶液小心地注入500mL容量瓶中.
③继续向容量瓶中加水至距离刻度线1-2cm处,改用胶头滴管加水至刻度线.
④用少量水洗涤烧杯和玻璃棒2-3次,每次将洗涤液转入容量瓶,并摇匀.
⑤将容量瓶塞紧,充分摇匀.
其正确的操作顺序为______(填序号).
(4)在配制过程中,其他操作都正解,下列操作会引起误差偏高的是______
A、未洗涤烧杯、玻璃棒;
B、未等NaOH溶夜冷却至室温就转移到容量瓶中;
C、容量瓶不干燥,含有少量蒸馏水;
D、定容时俯视视标线;
E、定容时仰视标线
(5)在进行②操作时,不慎有液体溅出,应怎样处理才能达到实验的主要目的:______.
参考答案:(1)所需的基本仪器可由实验步骤得出:托盘天平、烧杯、玻璃棒、500 mL容量瓶、胶头滴管、钥匙,配制时,必须使用的仪器有:①④⑤⑥,还缺少的是:胶头滴管、钥匙,
故答案为:①④⑤⑥;胶头滴管、钥匙;
(2)在溶解氯化钠时,使用玻璃棒进行搅拌;转移溶液时使用玻璃棒引流,防止溶液流到容量瓶外面,
故答案为:搅拌;引流;
(3)配制500mL0.5mol/L的氯化钠溶液,需要氯化钠0.25mol,质量为58.5g/mol×0.25mol≈14.6g,
溶液的配制过程为:计算-称量(量取)-溶解(稀释)-移液-洗涤-定容-摇匀-装瓶,因此其正确的步骤为:①②④③⑤,
故答案为:14.6;①②④③⑤;
(4)A、未洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量减小,溶液浓度偏低,故A错误;
B、未等NaOH溶夜冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液的体积偏小,配制的溶液浓度偏高,故B正确;
C、容量瓶不干燥,含有少量蒸馏水,不影响配制结果,故C错误;
D、定容时俯视视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故D正确;
E、定容时仰视标线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故E错误;
故选BD;
(5)在配制溶液的过程中,出错了应重新配制,否则会使配得的溶液浓度出现错误,
故答案为:重新配制.
本题解析:
本题难度:一般