微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或表示方法正确的是
[? ]
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g)?△H=-285.8?kJ·mol-1
C.吸热反应都需加热才能完成
D.热化学方程式的化学计量数只表示物质的量,不表示物质的分子数或原子数
参考答案:D
本题解析:
本题难度:简单
2、选择题 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出的c(H+) =1×10-5 mol/L
B.c(A-) + c(HA) ="2c" (Na+) = 0.4 mol/L
C.HA溶液中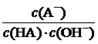 与上述混合溶液中
与上述混合溶液中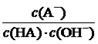 相等
相等
D.c(A-)-c(HA)? =" 2" c (OH-)-2c (H+)
参考答案:C
本题解析:根据题意知,室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合,所得溶液为0.1mol/L HA和0.1mol/L NaA的混合液,混合溶液的pH=5,则HA为弱酸,混合液中HA的电离程度大于NaA的水解程度。A、混合溶液中由水电离出的c(H+) =1×10-9 mol/L,错误;B、根据混合液中的物料守恒知,c(A-) + c(HA) ="2c" (Na+) = 0.2mol/L,错误;C、根据HA的电离常数表达式及水的离子积常数
表达式知,溶液中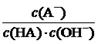 ="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中
="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中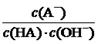 与上述混合溶液中
与上述混合溶液中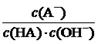 相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA)? ="2c" (H+)— 2 c (OH-),错误。
相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA)? ="2c" (H+)— 2 c (OH-),错误。
本题难度:一般
3、选择题 已知热化学方程式C2H2 (g)+5/2O2 (g)=2CO2 (g)+H2O(g);△H="-1256" kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256kJ/mol
B.若生成2mol 液态水,则放出的热量小于2512kJ
C.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
D.若转移10mol电子,则消耗2.5molO2
参考答案:D
本题解析:略
本题难度:一般
4、填空题 (8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①硫酸溶液
| ②硫酸氢钠溶液
| ③醋酸溶液
| ④盐酸
|
HSO4-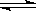 H++SO42— H++SO42—
| HSO4-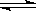 H++SO42- H++SO42-
| CH3COOH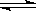 CH3COO-+H+ CH3COO-+H+
| HCl = H++Cl-
|
10℅
| 29℅
| 1.33℅
| 100℅
|
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式?
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是?(填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是?;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:?
参考答案:(1)H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O?(2)①④②③
(3)③②①④?(4)硫酸的一次电离抑制了HSO4-的电离
本题解析:(1)根据已知信息可知,硫酸的第二步电离存在电离平衡,所以和氢氧化钡反应的方程式为H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O。
(2)硫酸的第二步电离的电离度是10%,所以硫酸溶液中氢离子的浓度为0.1mol/L+0.1mol/L×10%=0.11mol/L。盐酸全部电离,氢离子浓度是0.1mol./L。磷酸氢钠溶液中HSO4-的电离度是29%,所以氢离子浓度为0.1mol/L×0.29=0.029mol/L。醋酸的电离度是1.33%,所以氢离子浓度是1.33%×0.1mol/L=0.00133mol/L,所以大小顺序为①④②③。
(3)酸越弱,当pH相等时,相应物质的浓度就越大,即醋酸的浓度大于磷酸氢钠的浓度。因为硫酸是二元酸,盐酸是一元强酸,因此当pH相同时,硫酸最终提供的氢离子要多于盐酸中的氢离子,所以大小顺序为③②①④。
(4)HSO4-能电离出氢离子,而硫酸第一步完全电离,生成的氢离子,可抑制HSO4-能电离。
本题难度:一般
5、选择题 能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5?
A.①③④
B.①②
C.②④
D.②
参考答案:C
本题解析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在, 就证明了弱电解质。所以可以从以下方面判断醋酸是否是弱电解质:电离平衡方面、水解方面、离子浓度方面,据此判断正误。
①用浓硫酸和醋酸钠固体共热可以制得醋酸,利用的是醋酸的挥发性,所以不能证明醋酸是弱酸,故错误;②醋酸钠水溶液呈碱性,说明醋酸钠是强碱弱酸盐,所以能说明醋酸是弱酸,故正确;③醋酸能和碳酸钙反应放出CO2,说明醋酸酸性比碳酸强,但不能说明醋酸的电离程度,所以不能证明醋酸是弱酸,故错误;④pH=2的醋酸溶液稀释1000倍后的pH<5,说明醋酸存在电离平衡,稀释促进电离,能证明醋酸是弱酸,故正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和逆向思维能力。该题的关键是明确弱电解质的电离平衡特点,答题时注意从以下方面判断电解质是否是弱电解质:电离平衡方面、水解方面、离子浓度方面。
本题难度:简单