微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+.此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物.现有3组离子,每组有2种金属离子.请各选用1种试剂,将它们两者分开.可供选用的试剂有:A?硫酸?B?盐酸?C?硝酸?D?氢氧化钠溶液?E?氨水(填写时用字母代号)
请填写下表:
| ?离子组 | 选用的试剂(填代号) | ?沉淀物的化学式 | 保留在溶液中的离子
Zn2+和Al3+
Zn2+和Ba2+
Fe3+和Al3+
参考答案:向Zn2+和Al3+的离子中加入氨水,生成的Al(OH)3不溶于氨水,而生成Zn(OH)2白色沉淀,当氨水过量时,沉淀又溶解,生成了Zn(NH3)42+;
向Zn2+和Ba2+的离子中加入硫酸,生成的硫酸钡不溶于水,而硫酸与锌离子不反应,则锌离子保留在溶液中;
向Fe3+和Al3+的离子中加入氢氧化钠溶液,生成的Al(OH)3能溶于氢氧化钠生成AlO2-保留在溶液中,而生成的Fe(OH)3不溶于氢氧化钠,以沉淀析出;
故答案为:?离子组选用的试剂(填代号)?沉淀物的化学式保留在溶液中的离子Zn2+和Al3+EAl(OH)3Zn(NH3)42+Zn2+和Ba2+ABaSO4Zn2+Fe3+和Al3+DFe(OH)3AlO2-.
本题解析:
本题难度:一般
2、选择题 已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是
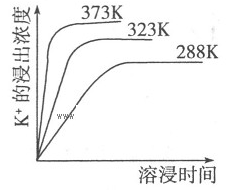
A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动
B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动
C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-)
D.升高温度,反应速率增大,平衡向正反应方向移动
参考答案:C
本题解析:向该体系中加入饱和氢氧化钠溶液时,氢氧根离子与镁离子反应生成难溶的氢氧化镁沉淀,降低了镁离子的浓度,使平衡向右移动,当加入碳酸钠溶液时,碳酸根离子与钙离子结合成碳酸钙沉淀,降低钙离子的浓度,使平衡向右移动,故A、B均正确;根据图像得出,温度越高,钾离子的浓度越大,说明升高温度,平衡向右移动,故D项正确;C项中平衡常数的表达式错误,故选C。
本题难度:一般
3、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
A.加入适量BaCl2(固体)?可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
|
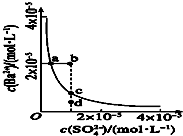
参考答案:A、硫酸钡溶液中存在着溶解平衡,c点在平衡曲线上,加入BaCl2,会增大c(Ba2+),平衡左移,c(SO42-)应降低,可以使溶液由d点变到c点,故A正确;
B、a点是沉淀溶解平衡线上的点是平衡状态,加水稀释,b点不可能变为沉淀溶解平衡曲线上的点,所bd点不可能到a点,故B错误;
C、d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故C正确;
D、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解.为得到纯净的氯化钠,有人设计这样方法:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体,对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,溶液中NaCl的物质的量浓度会变大
参考答案:A、NaCl固体在NaCl饱和溶液中的溶解是一种动态平衡,食盐颗粒小一些能加快溶解和析出的速率,有利于提纯.故A错误;
?B、设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不在增加,而MgCl2在NaCl饱和溶液中溶解未达到饱和,因此
MgCl2溶解只剩下纯净的NaCl.故B错误;
C、在饱和NaCl溶液中,NaCl固体的溶解处于平衡状态,溶解和析出同时存在,NaCl溶解的量不会再增加,但对于MgCl2并未达到饱和,因此最后的固体中只会存在NaCl.故C正确;
D、NaCl溶液已达到饱和,浓度不可能变大.故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法正确的是
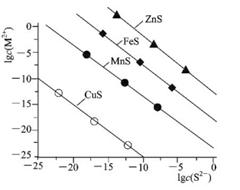
A.Ksp(CuS)约为l×10-20
B.向Cu2+浓度为10-5mol?L-1废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol?L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol?L-1 Na2S溶液,Zn2+先沉淀
D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)