微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂
B.每生成1molCO需转移2mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41
参考答案:B
本题解析:该反应中氮元素的化合价由0价降到-3价,被还原,氮气作氧化剂。碳元素由0价升高到+2价,被氧化、碳作还原剂,A、C错;B、正确;D、摩尔质量要带单位。
本题难度:一般
2、选择题 火法炼铜首先要焙烧黄铜矿,反应为:CuFeS2+O2 Cu2S+FeS+SO2?则下列说法正确的是
Cu2S+FeS+SO2?则下列说法正确的是
A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原
B.每生成1molSO2转移6mol电子
C.SO2既是氧化产物又是还原产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.3 mol氧气被还原
参考答案:B
本题解析:A.CuFeS2既是氧化剂又是还原剂,硫元素只被氧化。错误;B.根据反应过程中的元素的化合价的变化可知:每生成1molSO2转移6mol电子,正确;C.SO2既是氧化产物又是还原产物,FeS既不是氧化产物又不是还原产物,错误;D.根据方程式可知:每转移6mol的电子,有1mol的氧气反应,所以若转移1.2 mol电子,有0.2 mol氧气被还原,错误。
本题难度:一般
3、填空题 (10分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。
(1)氧化剂?,还原剂?
(2)用双线桥法标出反应中电子转移情况?
(3)氧化剂与氧化产物的质量比__________
(4)当生成28gN2时,被氧化的物质的质量是__________g。?
参考答案:(10分)(1)Cl2,NH3
(2)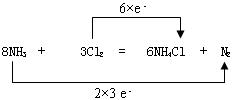
(3)___213_∶_28_____?(4)___34____g。
本题解析:略
本题难度:一般
4、填空题 (1)配平下列化学方程式_______S+_____NaOH _______Na2S+_____Na2SO3+______H2O ;
_______Na2S+_____Na2SO3+______H2O ;
(2)指出被氧化的元素是______,被还原的元素是______,氧化产物________,还原产物________,氧化剂与还原剂的质量比是_______;
(3)并用双线桥表示该反应转移的电子方向和数目________________________
参考答案:(1)3、6、2、1、3
(2)S(或硫);S(或硫);Na2SO3(或亚硫酸钠);Na2S(或硫化钠);2:1
(3)
本题解析:
本题难度:一般
5、选择题 取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
(?)
A.1∶1∶2
B.2∶1∶3
C.6∶3∶2
D.3∶2∶1
参考答案:C
本题解析:因为消耗的氯气的体积相等,因此在反应中得到的电子的物质的量是相等的,那么作为还原剂的这三种物质,在反应中所失去的电子数也是相等的,1 mol KI在转变成单质时,失去1 mol的电子,、1 mol Na2S被氧化时,失去2 mol电子,1 mol FeBr2被氧化时,失去3mol电子,因为在反应中氯气所得到的电子相等,所以消耗的KI、Na2S、FeBr2溶分别是6 mol、3mol、2 mol,又因为在同一溶液中,所以KI、Na2S、FeBr2溶液的物质的量浓度之比是6∶3∶2。选C。
本题难度:一般