微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入
100mL 0.020mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
[? ]
A.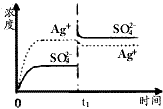
B.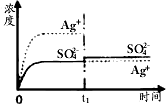
C.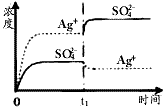
D.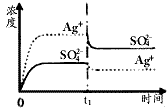
参考答案:B
本题解析:
本题难度:一般
2、填空题 (1)研究证明使用氯气作自来水消毒剂时,氯气会与水中有机物反应,生成CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发出多种自来水的新型消毒剂。下列物质不能作自来水消毒剂的是
_________ (填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸氧化铁盐(Ⅲ),写出该法的离子方程式:______________________。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质为KOH溶液,放电时的总反应:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极发生的电极反应式:_________________。
②用高铁(VI)电池作电源,以石墨作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成______L H2(标准状况)。
③下表列出了某厂排放的废水中锌的含量及国家环保标准值的有关数据
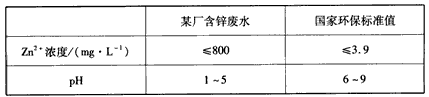
该厂只用调节pH的方法处理废水,当调整pH=7时,此时废水中Zn2+的浓度为__________mg/L,_______ (填“符合”或“不符合”)国家环保标准(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
参考答案:(1)AD
(2)10OH-+3ClO-+2Fe3+=3Cl-+2FeO42-+5H2O
(3)①FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-;②6.72;③78;不符合
本题解析:
本题难度:一般
3、选择题 已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量
B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目
D.溶液中溶质的质量分数
参考答案:D
本题解析:略
本题难度:一般
4、选择题 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
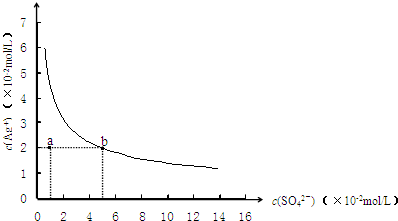
A.含有大量SO42-的溶液中肯定存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
参考答案:A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A正确;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.a点c(SO42-)=1×10-2mol/L,c(Ag+)=2×10-2mol/L,c2(Ag+)×c(SO42-)=4×10-6<ksp,不是饱和溶液,温度升高,物质溶解度也增大,溶度积常数增大,蒸发不能使溶液由a点变到b点,故D错误.
故选AB.
本题解析:
本题难度:简单
5、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA-? HA- H++A2-?完成以下问题:
H++A2-?完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
参考答案:(1) 碱性? B2-+H2O  ?HA-+OH-? (2) < ?(3)1.75×10-4
?HA-+OH-? (2) < ?(3)1.75×10-4
本题解析:二元酸(化学式用H2A表示)在水中的电离方程式是:H2A==H++HA-? HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O  ?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32-
?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32- CaCO3(1)+ SO42-的平衡常数
CaCO3(1)+ SO42-的平衡常数
K=c(SO42-)/c(CO32-)=Ksp[CaSO4]/Ksp[CaCO3]=4.90×10-5/=2.80×10-9=1.75×104。
点评:本题考查了盐的水解、溶度积,该题要理解二元酸在水中的电离方程式是:H2A==H++HA-
HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
本题难度:一般