微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.
①温度升高时,Ksp______(填“增大”、“减小”或“不变”下同).
②滴加少量浓盐酸,c(Ca2+)______,原因是______(用文字和离子方程式说明).
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______.若某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于______(已知Ksp[Cu(OH)2]=2.0×10-20).
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO32-水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)______.
2、选择题 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
[? ]
A.只有AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
3、选择题 将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20ml0.01mol
4、简答题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+
O2?SO3△H=-98KJ?mol-1
(1)在T1温度时,该反应的平衡常数K=,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,=______.[已知该温度时,KSP(BaSO4)=1.3×10-10,KSP(BaCO3)=5.2×10-9].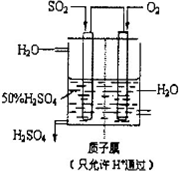
5、选择题 有关AgCl的溶解沉淀平衡的说法中,不正确的是( )
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体