|
高考化学知识点整理《热化学方程式》试题特训(2017年最新版)(四)
2017-07-27 09:55:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式正确的是 ( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+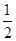 O2(g)===H2O(g) ΔH=-242 kJ·mol-1 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为
| H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
参考答案:C
本题解析: A.甲烷的燃烧热为890.3 kJ/mol,表示1mol的甲烷完全燃烧产生稳定的氧化物时所放出的热量,在通常情况下,水的稳定状态是液体,不是气态,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) ==CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol,错误;B.氮气与氢气合成氨的反应是可逆反应,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,发生反应的氮气的物质的量小于0.5 mol,因此热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH<-38.6 kJ/mol,错误;C.1 g H2的物质的量是0.5 mol,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+ 2NH3(g) ΔH<-38.6 kJ/mol,错误;C.1 g H2的物质的量是0.5 mol,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+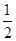 O2(g)==H2O(g) ΔH=-242 kJ/mol,正确;D.中和热为57.3 kJ/mol表示酸碱发生中和反应产生1mol的水所放出的热量,物质发生反应越多,反应放出的热量就越多,所以硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为1/2H2SO4(aq)+KOH(aq)=== 1/2K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol,错误。 O2(g)==H2O(g) ΔH=-242 kJ/mol,正确;D.中和热为57.3 kJ/mol表示酸碱发生中和反应产生1mol的水所放出的热量,物质发生反应越多,反应放出的热量就越多,所以硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为1/2H2SO4(aq)+KOH(aq)=== 1/2K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol,错误。
考点:考查热化学方程式书写的正误判断的知识。
本题难度:一般
2、选择题 CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574?kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=-1160?kJ/mol
下列说法不正确的是
[? ]
A.反应①②均为放热反应
B.反应①②转移的电子数相同
C.由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l)?ΔH=-a?kJ/mol,a<574
D.若用标准状况下4.48LCH4通过上述反应还原NO2至N2,放出的热量为173.4?kJ
参考答案:C
本题解析:
本题难度:一般
3、填空题 (6分)写出下列热化学方程式:
(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2g SiH4自燃放出热量89.2kJ,其热化学方程式为: ;
(2)在25℃、101kPa下,在稀溶液中,强酸强碱反应生成1mol 液态水放热57.3kJ。写出稀硫酸与烧碱溶液反应的热化学方程式______________ _________ __;
(3)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5KJ热量,写出热化学方程式 。
参考答案:(每小题2分,有错无分)(1)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1
(2)H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6kJ·mol-1[来源:91exam.org]
(3)C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1
本题解析:考查热化学方程式的书写。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
(1)2g SiH4自燃放出热量89.2kJ,所以1molSiH4燃烧放出的热量是89.2kJ×16=1427.2kJ,所以热化学方程式是SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1。
(3)60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5KJ热量,则1mol碳吸收的热量是657.5KJ÷5=131.5kJ,所以热化学方程式是C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1。
本题难度:一般
4、填空题 (16分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,CO2的排放量也要大幅减少。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
③CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)  CO(g) + H2(g) CO(g) + H2(g)
①该反应的化学平衡常数表达式为:K= 。
②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应: CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。 CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
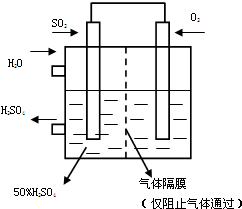
(2 )碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应_______________________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是: ___________。
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率 CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
如图所示。由下图可以得出的结论是(写两条):_____________________、___________________。

参考答案:Ⅰ.-1160KJ/mol (2分) Ⅱ.(1) ①K=[c(CO)?c(H2)] /c(H2O) (2分)②50%(2分) 0.6(2分) (2) ①SO2+2H2O+I2=4H++SO42-+2I- ②对于平衡:2HI(g)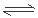 I2(g)+H2(g),分离出H2,实质是降低了生成物的浓度,使平衡向正反应方向移动(2分)。Ⅲ.其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快;(4分以上6条写2条即可,其它合理答案均可) I2(g)+H2(g),分离出H2,实质是降低了生成物的浓度,使平衡向正反应方向移动(2分)。Ⅲ.其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快;(4分以上6条写2条即可,其它合理答案均可)
本题解析:Ⅰ.③×2-①,整理可得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=2△H3-△H1=2×(-867kJ/mol)+574kJ/mol=-1160KJ/mol;Ⅱ.(1)①反应为C(s) + H2O(g)  CO(g) + H2(g) 的化学平衡常数表达式为: CO(g) + H2(g) 的化学平衡常数表达式为: ;②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:[ CO(g) + H2O(g) ;②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:[ CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为 CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为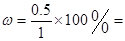 50%,则平衡时各种物质的浓度分别是:c(CO)=0.5mol/L;c(H2O)="2." 5mol/L;c(CO2)=0.5mol/L;c(H2)=1.5mol/L;所以800℃时该反应的平衡常数为 50%,则平衡时各种物质的浓度分别是:c(CO)=0.5mol/L;c(H2O)="2." 5mol/L;c(CO2)=0.5mol/L;c(H2)=1.5mol/L;所以800℃时该反应的平衡常数为 ;(2)①在反应器中SO2、I2、H2O发生氧化还原反应产生硫酸和氢碘酸,用离子方程式表示反应器中发生的反应是SO2+2H2O+I2=4H++SO42-+2I-;②碘化氢分解反应是可逆反应;当从反应体系分离出H2,实质是降低了生成物的浓度,根据平衡移动原理:降低生成物的浓度,平衡正向移动,可以使反应得到的I2再回到反应器中促进SO2的转化吸收;Ⅲ.根据图像可知其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快; ;(2)①在反应器中SO2、I2、H2O发生氧化还原反应产生硫酸和氢碘酸,用离子方程式表示反应器中发生的反应是SO2+2H2O+I2=4H++SO42-+2I-;②碘化氢分解反应是可逆反应;当从反应体系分离出H2,实质是降低了生成物的浓度,根据平衡移动原理:降低生成物的浓度,平衡正向移动,可以使反应得到的I2再回到反应器中促进SO2的转化吸收;Ⅲ.根据图像可知其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快;
考点:考查盖斯定律的应用、化学平衡常数和物质的平衡转化率的计算、外界条件对平衡的影响、图像法在化学反应平衡移动中的作用、离子方程式的书写的知识。
本题难度:困难
5、填空题 T℃时反应2SO2(g)+O2(g)

2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化?②容器内压强不再发生变化?③容器内气体原子总数不再发生变化?④相同时间内消耗2n?molSO2的同时生成n?molO2?⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
(5)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,______
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.
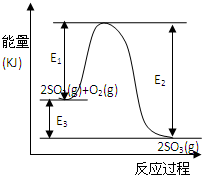
参考答案:(1)△H=反应物吸收的能量-生成物放出的能量═-E3kJ/mol=-(E2-E1)kJ/mol,
故答案为:2SO2(g)+O2(g)

2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
(2)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应.
? 2SO2(g)+O2(g)

2SO3(g)?放热?E3?
? 反应开始?3 mol?1mol? 0?E3?
?转化?1.8?mol? 0.9mol?1.8?mol? 0.9E3
?平衡?1.2mol? 0.1mol? 1.8?mol?
? 所以SO2的转化率=1.8mol3mol×100%=60%
故答案为:60%;放出;?0.9 E3;
(3)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等、体系各物质的含量不变.
①②④符合条件;根据原子守恒,各元素的原子总数始终不变,故③错;⑤所指方向一致,故⑤错.
故选:①②④;
(4)加入催化剂,改变了反应历程,改变反应速率,但平衡不移动,所以E2、E1 减小,E3不变,
故答案为:E2、E1 减小,E3不变;
(5)根据原电池反应原理,还原剂在负极上发生氧化反应,氧化剂在正极上发生还原反应,该原电池的本质是
2SO2+O2+2H2O=H2SO4,为维持浓度不变,SO2和O2反应生成硫酸的质量分数是50%,所需的水为反应反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:+:O2+4e-+4H+═2H2O,-:SO2-2e-+2H2O═SO42-+4H+;16:29;
(6)SOCl2中S的化合价是+4价,是中间价态,能发生氧化还原反应,反应中有二氧化硫生成,也有S单质生成,
故答案为:2SOCl2+4e-═S+SO2↑+4Cl-
本题解析:
本题难度:一般
|