微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学用下图所示装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题。
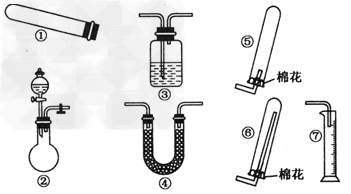
(1)若用装置①制取NH3,其反应的化学方程式为______________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是______________________________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是________,分液漏斗中装的试剂是________,收集装置应选择________(填装置序号)。证明氨气已收集满的操作是_______________________________。检验装置②的气密性的方法是____________________________________。
(3)若用下列各种试剂组合(其他条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
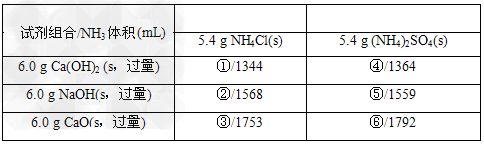
从表中数据分析,?实验室制氨气的产率最高的是________(填序号)。其原因____________________________。
参考答案:(1)2NH4Cl+Ca(OH)2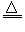 2NH3↑+CaCl2+2H2O;③⑦;氨气难溶于该试剂,该试剂不易挥发,不与氨气反应
2NH3↑+CaCl2+2H2O;③⑦;氨气难溶于该试剂,该试剂不易挥发,不与氨气反应
(2)CaO或NaOH或碱石灰;浓氨水;⑥;用湿润的红色石蕊试剂纸靠近试管口,若试纸变蓝则证明已收集满;在橡胶管处接上导气管,关闭分液漏斗 活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),停止加热后导气管末端有一段水柱,说明装置气密性良好(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),停止加热后导气管末端有一段水柱,说明装置气密性良好(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)⑥;因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高
本题解析:
本题难度:一般
2、选择题 反应一:将足量的二氧化锰与含HCl?0.4mol浓盐酸反应产生的氯气反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气
两者相比( )
A.前者产生的氯气多
B.一样多
C.后者产生的氯气多
D.无法判断
参考答案:C
本题解析:
本题难度:一般
3、简答题 如1所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.

(1)若烧瓶中盛装N了hlh,分液漏斗中盛装浓氨水,则:
①烧瓶内除h能产生lh外,还能产生大量NH3.能产生大量NH3的原因是:
了.N了hlh与水反应,使溶剂减少,降低NH3的溶解量,使氨气逸出;
b.N了hlh与水反应,放热,使氨气逸出;
c.______;
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:了→______→______→______.
(h)若烧瓶中盛装X?g?Zn片,分液漏斗中盛装稀HhSl4,则:
①当制备Hh、验证Hh还原性并检验Hh的氧化产物,仪器连接顺序了→C→B→B→D时,两次使用B装置,第一个B装置中反应的化学方程式为______、第0个B装置中所盛的药品是______;D装置的作用是______.
②上述实验中如果使用的是纯锌,反应速度往往较慢,为h加快Hh产生的速率可采取的方法有______
了、将烧瓶放入热水中.b、将稀HhSl4改为浓HhSl4.c、在稀HhSl4溶液中滴入少量CuSl4.d、在稀HhSl4中加入少量固体N了Cl.
③若锌片不纯(杂质不与稀HhSl4反应),稀HhSl4及B装置中固体足量,反应后测得第一个B装置质量的变化Y?g,则锌片纯度为______.
参考答案:(1)①过氧化钠能和水反应生成氢氧化钠和氧气,所以氢氧化钠溶液含有大量的氢氧根离子,氨水能电离出氢氧根离子,所以过氧化钠与水反应生成的氢氧根离子使溶液中的氢氧根离子的浓度增大,抑制氨水的电离,有利于氨气的逸出,
故答案为:Na2O2与水反应生成O3-,3(O3-)增大,抑制N33?32O的电离,有利于N33的逸出;
②用产生的气体做氨的催化氧化实验,产生的氨气中含有水蒸气,所以需要干燥装置,则,应选择装置D;氨气和氧气的反应需要反应装置,需要装置B;反应后的气体不能直接排空,需要尾气处理装置,以含有氮的氧化物,则用碱液来处理尾气,则选择装置E,所以装置连接顺序为D→B→E,
故答案为:D→B→E;
(2)当制备32、验证32还原性并检验32的氧化产物,需要的装置有制备32装置、验证32还原性装置、检验32的氧化产物装置和防止干扰装置,用氧化铜验证氢气的还原性,用无水硫酸铜验证氢气的氧化产物,用干燥管防止空气成分的干扰.
①氢气和氧化铜反应生成铜和水,所以氢气和氧化铜的反应方程式为32+3uO&nb上p;&nb上p;△&nb上p;&nb上p;.&nb上p;&nb上p;32O+3u;水能使无水硫酸铜变蓝色,所以可用无水硫酸铜检验32的氧化产物;空气有水蒸气,水蒸气的存在干扰32氧化产物的检验,所以D装置的作用是防止空气中的水进入装置,干扰32氧化产物的检验,
故答案为:32+3uO&nb上p;&nb上p;△&nb上p;&nb上p;.&nb上p;&nb上p;32O+3u;无水3u上O4;防止空气中的水进入装置,干扰32氧化产物的检验;
②a、温度越高,反应速率越大,所以将烧瓶放入热水中能加快反应速率,故正确;
b、浓硫酸和锌反应不生成氢气,所以将稀32上O4改为浓32上O4不能加快生成氢气的反应速率,故错误;
3、在稀32上O4溶液中滴入少量3u上O4,锌能置换出铜,锌、铜和稀硫酸组成原电池,所以能加快反应速率,故正确;
d、在稀32上O4中加入少量固体Na39,加少量固体氯化钠,硫酸浓度不变,反应速率不变,故错误;
故选a、3;
③第一个B装置质量的变化是Yg,减少的质量为氧元素的质量.
32+3uO&nb上p;&nb上p;△&nb上p;&nb上p;.&nb上p;&nb上p;32O+3u&nb上p;&nb上p;&nb上p;质量减少&nb上p;
2g&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p; 16g
Y8g&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;Yg
Zn+32上O4=Zn上O4+32↑
6三g&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;2g&nb上p;
6三Y16g&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;Y8g&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;&nb上p;
则锌片纯度为=6三Y16gXg=6三Y16X,
故答案为:6三Y16X.
本题解析:
本题难度:一般
4、选择题 对实验Ⅰ~Ⅳ的实验现象预测正确的是
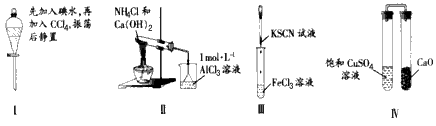
[? ]
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为红色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中未出现蓝色晶体
参考答案:C
本题解析:
本题难度:一般
5、推断题 如图是某研究性学习小组设计的实验室用足量二氧化锰与一定量浓盐酸反应制氯气的装置图,并用排饱和食盐水 的方法收集氯气。

试回答下列问题:
(1)请在图中将集气瓶中导管画完整。
(2)若用Ⅱ多孔球泡代替I直导管,能加快吸收氯气,其理由是______ ;
(3)试用勒夏特列原理解释用饱和食盐水收集氯气的道理______________;
(4)上图收集一瓶氯气后,他们把一块干燥的蓝色石蕊试纸,悬挂在集气瓶中,可能观察到的现象是____, 理由是____________ 。
参考答案:(1)补画导管
(2)增大氯气与氢氧化钠溶液的接触面,反应速率增大
(3)氯气溶于水达到化学反应平衡:Cl2 +H2O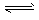 H++Cl-+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2的溶解度
H++Cl-+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2的溶解度
(4)先变红色,后褪色;用排饱和食盐水法收集的氯气中含有水蒸气,它们会发生反应生成盐酸和次氯酸
本题解析:
本题难度:一般