微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物酸锰(MnFe2O4)也可用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
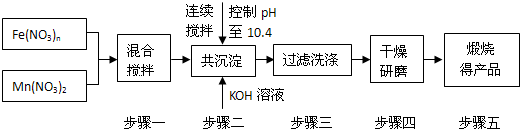
(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______.
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______.
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4
MnFe2O4-x+O2↑?MnFe2O4-x+xH2O→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中X=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为______.
②该热化学循环制氢的优点有(答两点即可)______.
参考答案:(1)Mn为+2价,令MnFe2O4中Fe的化合价为a价,根据化合价代数和为0,则2+2a+4×(-2)=0,解得a=+3,则Fe(NO3)n中n=3.
由MnFe2O4组成可知:Fe和Mn的个数之比为1:2,根据质量守恒可知,Fe(NO3)n与Mn(NO3)2 二者之比 2:1.
故答案为:3;2:1;?
(2)连续搅拌是为了让二者充分反应.沉淀可能附着KOH等,洗涤至中性,说明洗涤干净,保证产物纯净.
故答案为:充分反应或沉淀完全;洗涤至流出液呈中性.
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有x+y=2,2x+3y=4.4,联立解得:x=1.6,y=0.4,
则1mol MnFe2O4-0.8中含Fe2+的物质的量为1.6mol,则Fe2+占的百分率为1.6mol2mol×100%=80%.
故答案为:80%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等.
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等.
本题解析:
本题难度:一般
2、选择题 下列分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.用分液漏斗分离汽油和植物油
参考答案:A、食盐水中的泥沙是难溶物质,分离不溶物和溶液可用过滤的方法,故A正确;
B、自来水中含有难挥发性物质,可通过蒸馏方法分离,故B正确;
C、碘单质易溶于有机溶剂四氯化碳,可通过萃取方法分离,故C正确;
D、汽油和植物油是互溶的两种物质,互溶物的分离不能采用分液法,故D错误.
故选D.
本题解析:
本题难度:一般
3、填空题 欲除去下表中各粉末状混合物中的杂质(括号内为杂质),请填写所用的试剂、操作名称及化学方程式。
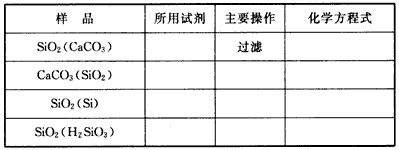
参考答案: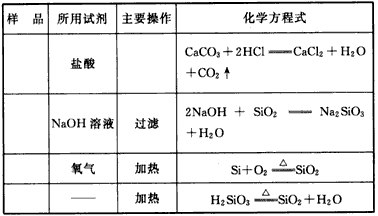
本题解析:
本题难度:一般
4、选择题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3 + Cu =2FeCl2 + CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:
(1)取100 mL废液加入足量的AgNO3溶液,生成沉淀 86.1g。
(2)另取100 mL废液放入铜片充分反应,铜片质量减少了2.56 g。
下列关于原废液组成的判断错误的是
A.c(Fe2+)︰c(Fe3+)︰c(Cu2+) = 2︰1 ︰1
B.c(Fe2+)︰c(Cu2+) = 2︰1
C.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ
D.c(Clˉ) =6mol / L,c(Fe 2+) = 1.2mol / L
参考答案:A
本题解析:试题分析:(1)沉淀是AgCl为86.1g,即0.6mol,n(Clˉ)=0.6mol,c(Clˉ)= 6mol/L, n(Fe3+)=0.2mol,故c(Fe3+)=2 mol/L。
(2)铜片质量减少了2.56 g即,参加反应的铜的物质的量为0.04mol,根据化学方程式计算,100 mL废液中还有FeCl3的物质的量为0.08mol。
综合以上分析,100 mL废液加n(Fe3+)=0.2mol,反应的n(Fe3+)=0.12mol。根据化学方程式计算,溶液中的物质的量为:n(Fe2+)=0.12mol,n(Cu2+)=0.6mol。浓度分别为:c(Fe2+)=1.2 mol / L;c(Fe3+)="0.8" mol / L;c(Cu2+)="0.6" mol / L。
A、c(Fe2+)︰c(Fe3+)︰c(Cu2+)? = 1.2︰0.8︰0.6=6:4:3,故错。
故选A。
考点:铁盐和亚铁盐的相互转变 化学计算
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,要注意根据铁和铜的活动性强弱确定反应的先后顺序。
本题难度:简单
5、选择题 现有三组溶液:①氯化钠和单质溴的水溶液?②汽油和氯化钠溶液
③19%的乙醇溶液,分离以上各混合液的正确方法一次是(?)
A.萃取、分液、蒸馏
B.分液、萃取、蒸馏
C.萃取、蒸馏、分液
D.蒸馏、分液、萃取
参考答案:A
本题解析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质。单质溴易溶在有机溶剂中,萃取即可;汽油不溶于水,分液即可;乙醇和水互溶,蒸馏即可,所以答案选A。
本题难度:简单