微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ba2+是一种重金属离子,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL?0.100mol/L标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要______________。
(2)需准确称取Na2S2O3固体的质量为____________g
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。有关的离子方程式为:
①Cr2O72-+6I-+14H+==2Cr3++3I2+7H2O
②I2+2S2O32-==2I-+S4O62-
试计算该工厂废水中Ba2+的物质的量浓度。
2、选择题 在氧化还原反应中,水作为氧化剂的是
A.C+H2O(g)CO+H2
B.3NO2+H2O===2HNO3+NO
C.2Na2O2+2H2O===4NaOH+O2↑
D.2F2+2H2O===4HF+O2
3、选择题 把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是?
[? ]
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2,且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
4、选择题 在一定条件下,下列粒子的还原性顺序为:Cl-<Br-<Fe2+<I<SO2,由此判断以下各应的溶液中不能发生的是
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.2Br-+4H++SO42-=SO2+Br2+2H2O
C.2Fe2++Cl2=2Fe3++2Cl-
D.I2+SO2+2H2O=4H++SO42-+2I-
5、选择题 下列反应中,电子转移方向和数目不正确的是( )
A.
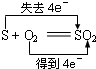
B.
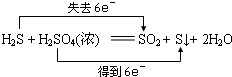
C.
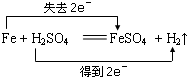
D.
