|
高中化学知识点归纳《水的电离平衡》高频考点预测(2017年最新版)(十)
2017-07-27 10:12:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (10分)25℃时,有下列五种溶液:
①0.1mol/L CH3COOH溶液 ②pH="13" NaOH溶液 ③0.05mol/L H2SO4
④0.1mol/L Na2CO3溶液 ⑤含有足量AgCl固体的饱和AgCl溶液
请根据要求填写下列空白:
(1)溶液④的pH 7(填“>、<、=”),其原因是 (用离子方程式表示)
(2)将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,
则a:b =
(3)若溶液④和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,
该反应的离子方程式为
(4)在溶液⑤中分别放入:
A.10mL蒸馏水;
B.50mL 0.2 mol?L?1AgNO3溶液;
C.60 mL 0.1mol?L?1AlCl3溶液;
D.100mL 0.1 mol?L?1盐酸溶液。充分搅拌后,Ag+浓度最小的是(填序号)
|
参考答案:(1) > , CO32- + H2O 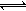 HCO3- + OH- (2) 1:1 HCO3- + OH- (2) 1:1
(3) 2Al3+ + 3CO32- + 3H2O ="=" 2Al(OH)3↓+ 3CO2↑ (4)C
本题解析:(1)0.1mol/L Na2CO3溶液,碳酸钠为强碱弱酸盐,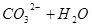  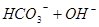 ,所以溶液呈碱性,PH>7;(2)氢氧化钠为强碱,硫酸为强酸,混合后PH=7,即恰好完全反应, ,所以溶液呈碱性,PH>7;(2)氢氧化钠为强碱,硫酸为强酸,混合后PH=7,即恰好完全反应,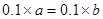 ,a:b =1:1;(3)Na2CO3溶液和Al2(SO4)3溶液发生双水解,反应的方程式为 ,a:b =1:1;(3)Na2CO3溶液和Al2(SO4)3溶液发生双水解,反应的方程式为
2Al3+ + 3CO32- + 3H2O ="=" 2Al(OH)3↓+ 3CO2↑ ;(4)根据氯化银的溶度积,氯离子浓度越大,银离子浓度越小,故Ag+浓度最小的是0.1mol?L?1AlCl3溶液。
考点:本题考查弱电解质电离和盐的水解。
本题难度:一般
2、填空题 (16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g) 2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。 2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
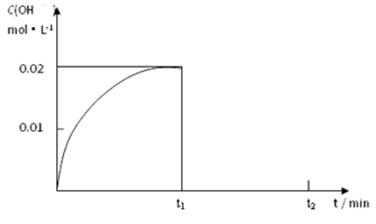
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
参考答案:(16分,每空2分)
I.(1)硫酸 (或者H2SO4)
(2)a d
(3)①在常压下,此反应的转化率已经达到96%,没有必要再增大压强了。
②-396.00 kJ/mo1
Ⅱ.(1)① 4.00×10-4
②
(2)① < ② 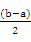
本题解析:I.(1)二氧化硫的催化氧化是工业生产硫酸的重要步骤;
(2)a、每生成1mol SO3的同时生成0.5mol O2,代表正逆两个反应方向且符合化学方程式中的系数比,符合正逆反应速率相等,达到平衡状态,正确;b、恒容条件下,气体的质量不变,所以气体的密度一直不变,不能判断是否达平衡状态,错误;c、体系中各物质的物质的量之比等于化学计量数之比时不一定达平衡状态,错误;d、该反应的特点是反应前后的气体的物质的量发生改变,所以恒容时气体的压强在变,达平衡时,气体压强不再变化,正确,答案选ac。
(3)①常压下,平衡时二氧化硫的转化率是96%,已经很高,所以没有必要再增大压强了;
②二氧化硫转化96%放出190.08KJ的热量,所以1mol二氧化硫气体完全反应则放出190.08kJ÷96%=198.00kJ的热量,所以该反应的热化学方程式中二氧化硫的系数是2,代表2mol的二氧化硫完全反应,放出的热量是198.00kJ×2=396.00kJ,所以△H=-396.00 kJ/mo1;
II.(1)①根据题意可知氨水的浓度是1mol/L, c(NH4+)= c(OH-)=0.02mol/L,所以氨水的电离常数K= c(NH4+)· c(OH-)/c(NH3·H2O)= 0.022mol/L/1mol/L= 4.00×10-4
②氨水稀释会促进一水合氨的电离,体积变为原来的2倍,则氢氧根离子浓度减小为原来的一半,根据勒夏特列原理,最终氢氧根离子、铵根离子的浓度仍会减小,所以图像的起点在0.01处,最大值在原图像的下方,如图 ; ;
(2)①若a=b,则二者恰好完全反应,溶液呈酸性,现在溶液呈中性,说明氨水过量,所以a<b;
②设二者的体积均是1L,因为b>a,则剩余氨水的物质的量是b-a,体积扩大到原来的2倍,所以剩余氨水浓度:c(NH3·H2O)=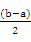 。 。
考点:考查化学平衡状态的判断,转化率的计算,热效应的计算,弱电解质的电离平衡的应用
本题难度:一般
3、填空题 (8分)⑴ 现有0.1mol·l-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作 。
⑵ 欲使0.1mol-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 ( )
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
⑶ 为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是( )
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
⑷ 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
参考答案:(8分)(每空2分)
⑴ 把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH
⑵ B
⑶ A
⑷ 向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱溶液的碱性是由CO32-引起的
本题解析:(2)Na2CO3溶液中由于CO32-水解,CO32-+H2O HCO3-+OH-,导致c(Na+)>2 c(CO32-)。故可以加KOH,抑制其水解,符合题意。但加盐酸将发生:CO32-+H+=HCO3-,破坏CO32-,不符合题意;同样,加水稀释会促进其水解,不符合题意;加适量的NaOH,虽然能抑制其水解,但同时增加了Na+,不会满足题意 HCO3-+OH-,导致c(Na+)>2 c(CO32-)。故可以加KOH,抑制其水解,符合题意。但加盐酸将发生:CO32-+H+=HCO3-,破坏CO32-,不符合题意;同样,加水稀释会促进其水解,不符合题意;加适量的NaOH,虽然能抑制其水解,但同时增加了Na+,不会满足题意
(3)B:本质是发生了中和反应,有中和热的放出,导致温度升高
C:硝酸铵晶体溶于水,其溶解过程是吸热过程,导致水温降低
D:氨水加入氯化铵固体,是由于氨根离子的增多,抑制了氨水的电离,导致碱性减弱
本题难度:困难
4、选择题 已知在100 ℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液温度均为100 ℃。下列说法中正确的是
A.0.001 mol·L-1的H2SO4溶液,pH=2
B.0.001 mol·L-1的NaOH溶液,由水电离出来的C(H+)=1×10-11 mol·L-1
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液50 mL
|  H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是