微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分) A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②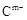 、
、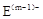 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
HmDm的电子式___________________。(1分)
能证明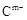 、
、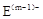 的还原性强弱的离子方程式为__________________________________。
的还原性强弱的离子方程式为__________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:__________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。
在该溶液中溶质中含有的化学键类型是 (1分)
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。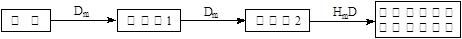
参考答案:(10分,每空2分)
(1) 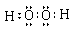 (1分)
(1分)
(2) Cl2 + S2-= 2Cl-+ S↓
(3) Cl2 + 2OH-= Cl-+ ClO-+ H2O
(4) H2S+ OH-= HS-+ H2O 离子键和共价键(1分)
(5) Na、S
本题解析:(1)根据①可知C、D是同主族元素,D的非金属性比C强,所以D是第二周期,C是第三周期元素;根据③④可知A是第一主族元素,B是第三主族元素,且都是第三周期元素,所以A 是Na,B是Al,则D是O,C是S元素,所以E是Cl元素。HmDm的电子式即过氧化氢的电子式为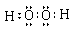 ;
;
(2)S2-的还原性比Cl-的还原性强,是因为有Cl2 + S2-= 2Cl-+ S↓离子反应发生;
(3)A和D的化合物的水溶液是氢氧化钠溶液,E的单质是氯气,则氯气与氢氧化钠溶液反应的离子方程式为Cl2 + 2OH-= Cl-+ ClO-+ H2O;
(4)A的最高价氧化物对应的水化物溶液是氢氧化钠溶液,与等物质的量的H2S反应生成硫氢化钠和水,离子方程式为H2S+ OH-= HS-+ H2O;该溶液的溶质是NaHS,所含化学键的类型是离子键和共价键;
(5)在上述元素中可以发生二次氧化的元素是Na、S,Na与氧气反应生成氧化钠,氧化钠与氧气加热生成过氧化钠,过氧化钠与水反应生成氢氧化钠,符合流程图;S与氧气反应生成二氧化硫,二氧化硫与氧气在一定条件下反应生成三氧化硫,三氧化硫溶于水生成硫酸。
考点:考查元素的推断,元素及其化合物的化学性质,离子方程式、电子式的书写,化学键的判断
本题难度:困难
2、填空题 (10分)元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为 。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为 。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为 。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为 。
(5)已知下列两反应过程中能量变化如图所示:
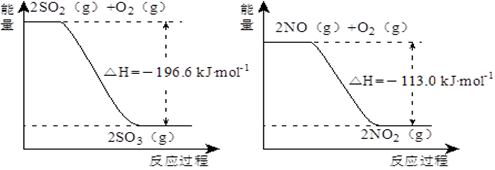
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。
参考答案:(1)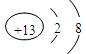 (2分)(2)Cl2 + H2S = S↓ + 2HCl 或Cl2 + Na2S = S↓+ 2 NaCl(2分)
(2分)(2)Cl2 + H2S = S↓ + 2HCl 或Cl2 + Na2S = S↓+ 2 NaCl(2分)
(3)[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-](2分)
(4)2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+(2分)
(5)NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1 (2分)
本题解析:(1)在第三周期元素中,半径最小的简单离子是铝离子,其离子结构示意图为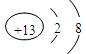 。
。
(2)非金属性强元素单质能置换出非金属性弱的单质,则能证明氯的非金属性(得电子能力)比硫强的化学方程式为Cl2 + H2S = S↓ + 2HCl。
(3)NaHSO3溶液中电离程度大于水解程度,因此溶液呈酸性,所以其溶液中离子浓度由大到小的顺序为[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-]。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,则根据电子得失守恒以及质量守恒定律可知该反应的离子方程式为2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+。
(5)根据图像可知反应的热化学方程式为① O2(g) +2SO2(g) =2SO3(g) △ H =-196.6kJ·mol-1、②2NO(g) + O2(g) =2NO2(g) △ H = -113.kJ·mol-1,则根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1。
考点:考查元素周期律的应用以及热化学方程式书写等
本题难度:一般
3、选择题 下列表示对应化学反应的离子方程式正确的是( )
A.用亚硫酸钠溶液处理纸浆中的残氯:SO32-+ 2OH-+ Cl2= 2Cl-+ SO42-+ H2O
B.二氧化硫通入足量的溴水中:SO2 + Br2 +2H2O = 2HBr+2H++SO42-
C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
D.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
 CO2↑+H2O+2CH3COO-
CO2↑+H2O+2CH3COO-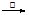 ClCH2COO-+ H2O
ClCH2COO-+ H2O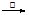 Cu2O↓+CH3COO—+3H2O
Cu2O↓+CH3COO—+3H2O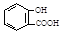 )中毒反应,可静脉注射NaHCO3溶液:
)中毒反应,可静脉注射NaHCO3溶液: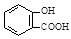 + 2 HCO3- →
+ 2 HCO3- → 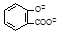 + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O