|
高考化学知识点总结《原电池原理》高频考点特训(2017年练习版)(八)
2017-07-27 10:20:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是
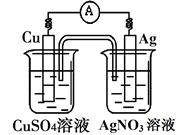
A.铜电极是正极,其电极反应为Cu-2e-=Cu2+
B.银电极上发生还原反应,电极质量增加
C.当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过
D.外电路中电子由银电极流向铜电极
|
参考答案:B
本题解析:活泼金属为负极,故A错误;银电极为正极,银电极上发生还原反应,Ag++e-= Ag,电极质量增加,故B正确;电解质溶液中没有电子通过,故C错误;外电路中电子由铜电极流向银电极,故D错误。
考点:本题考查原电池原理。
本题难度:一般
2、实验题 (8分)某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。

正极反应式: ;负极反应式: 。
若该电池中有0.1mol的电子转移,请问消耗 克Fe
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): __________________,用离子方程式表示其反应原理:______________
参考答案:(共8分)
方案Ⅰ:Fe+2H+=Fe2++H2↑(1分)
方案Ⅱ:(画装置图完全正确2分,合理的均给分)

2H++2e- =H2↑(1分) Fe-2e-=Fe2+(1分) 2.8 g
方案Ⅲ:把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质(1分)Fe+Cu2+ = Cu+Fe2+(1分)
本题解析:金属的活动性有多种验证方法。例如与水和酸置换氢气的能力;最高价氧化物水化物的碱性强弱;原电池原理;电解原理的应用、金属之间的置换等等。
本题难度:一般
3、填空题 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.

(1)A、B、C三个装置中属于电解池的是______.
(2)A池中Cu是______极,A池中总反应的离子方程式为______.
(3)B池中C电极上发生______反应(填“氧化”或“还原”),B池中总反应的化学方程式为______.
(4)C池中Cu是______极,电极反应为______.反应过程溶液中C(Cu2+)______(填“变大”“变小”或“不变”).
参考答案:(1)BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,故选BC;
(2)该装置是原电池,较活泼的金属锌作负极,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(3)B电池中,C连接原电池负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,阳极上氯离子失电子发生氧化反应,所以电池反应式为:CuCl2?电解?.?Cl2↑+Cu,故答案为:还原;CuCl2?电解?.?Cl2↑+Cu;
(4)铜连接原电池的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得 电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变,故答案为:阳;Cu-2e-=Cu2+;不变.
本题解析:
本题难度:一般
4、计算题 (6分)若定义某物质的转化率为消耗掉的该物质的物质的量占起始时该物质的原物质的量的百分比。已知合成氨反应为N2(g) + 3H2(g)  ?2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求: ?2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
(1)氮气的转化率
(2)用氢气表示平均反应速率是多少?
(3)平衡状态时氢气的物质的量浓度。
参考答案:
(1)30%?(2)0.0225 mol·(L·min)-1?(3)0.21 mol·L-
本题解析:略
本题难度:简单
5、选择题 将铜棒和铝棒用导线连接后插入浓硝酸溶液中,下列叙述正确的是
A.该装置能形成原电池,其中铝是负极
B.该装置能形成原电池,其中铜是负极
C.该装置不能形成原电池
D.以上说法均不正确
参考答案:B
本题解析:本题有两个活性不同的电极和电解质溶液,并形成了闭合回路,可形成原电池。但铝在浓硝酸中钝化,活性较铜差,做电池正极。
本题难度:简单
|