微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在灾后重建中,饮用水安全占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
阳离子
| K+、Na+、Cu2+、Al3+
|
阴离子
| SO42—、HCO3—、NO3—、OH-
|
?
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液。
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解。
③进行焰色反应实验,只有B、C含有钾离子。
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀。
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出B、C、D的化学式:B________、C________、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式________________________________________
(4)C常用作净水剂,用离子方程式表示其净水原理_______________________________
参考答案:(1)KNO3 KAl(SO4)2 CuSO4 (2)Na2CO3
(3)Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2—+2H2O
(4)Al3++3H2O=Al(OH)3(胶体)+3H+
本题解析:根据题干可知,A和B、C和D均能大量共存。由①知:D溶液中含Cu2+,则C中不含OH-、HCO3—。由②知:E溶液中含OH-,C溶液中含Al3+。由③知:B、C溶液中含有钾离子,A、D、E中不含钾离子。由④知:A中含HCO3—,C、D溶液中含SO42—,B、E中不含SO42—。由⑤可知:B中不含OH-、HCO3—。综上所述,
D为CuSO4 , C为KAl(SO4)2,E为NaOH ,B为KNO3,A为NaHCO3。
本题难度:一般
2、选择题 在溶液中加入足量Na2O2后仍能大量共存的离子组是
[? ]
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
参考答案:B
本题解析:
本题难度:一般
3、选择题 某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00? mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
参考答案:D
本题解析:根据实验①判断,原溶液中一定有Mg2+,无NH4+。参加反应的OHˉ: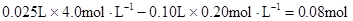 ,n(Mg2+)=
,n(Mg2+)=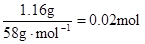 ? Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ:
? Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ: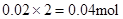 ,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ:
,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ: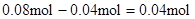 ,因滤液中还余OHˉ,则发生反应?Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )=
,因滤液中还余OHˉ,则发生反应?Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )= 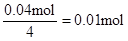 ;由实验②结合上面的计算数据,得 n(Clˉ)=
;由实验②结合上面的计算数据,得 n(Clˉ)=  ;? n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ?;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) =
;? n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ?;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) = 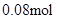 ?n(Na+ ) =
?n(Na+ ) = 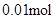
原溶液中离子的浓度:
c (Clˉ) =  ?c (Al3+)=
?c (Al3+)=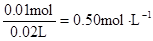
c (Mg2+)=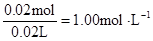 ? c(Na+ )=
? c(Na+ )= 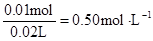
故选D。
本题难度:一般
4、选择题 下列关于溶液中离子的说法正确的是( )
A.0.1mol/LNa2C03溶液中离子浓度关系:c(Na+)=2c(CO2-3)+c(HCO-)十c(H2C03)
B.0.1mol/LNH4Cl和0.1mol/LNH3?H20等体积混合后溶液中离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,醋酸纳溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中c(Na+)=c(CH3COO-)
D.常温下,pH=l的溶液中,Fe2+、I-、ClO-、NO-3能够大量共存
参考答案:A、0.来源:91考试网 91ExAm.org11mol/LNa2C03溶液中存在物料守恒:c(Na+)=2[c(CO32-)+c(HCO3-)十c(H2C03)],故A错误;
B、NH4Cl和NH3?H20等体积混合后溶液显示碱性,c(H+)<c(OH-),所以氨水的电离程度大于氯化铵的水解程度,
即c(NH4+)>(Cl-)>c(OH-)>c(H+),故B错误;
C、醋酸钠溶液中滴加少量醋酸后形成的混合液中,根据电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-),溶液的pH=7,则c(H+)=c(OH-),所以c(Na+)=c(CH3COO-),故C正确;
D、pH=l的溶液中,含有大量的氢离子,Fe2+、NO3-不能共存,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 能在溶液中大量共存,加入绿矾后仍能大量存在的离子组是
A.K+、Ba2+、OH—、I—
B.Na+、Mg2+、Cl—、SO42—
C.Na+、H+、Cl—、NO3—
D.Cu2+、S2—、Br—、ClO—
参考答案:B
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。绿矾溶于水电离出Fe2+和SO42-,则A溶液中的Ba2+、OH-均不能大量共存;B可以,C中的硝酸能氧化亚铁离子,不能大量共存;D中的ClO-能氧化S2-以及Fe2+,均不能大量共存,答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般