微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E五种微粒具有相同的电子数,它们之间能发生如下反应:A+B=C+D;如果将B、D、E?混合B少量则有白色沉淀,B过量则无沉淀,请回答:
(1)用化学符号表示下列4种微粒:A:______B:______C:______D:______
(2)写出B、D、E?混合B过量时的离子方程式:______.
参考答案:A、B、C、D、E五种微粒具有相同的电子数,可以从10电子微粒来分析判断,10电子微粒:
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+
二核:HF、OH-
三核:H2O、NH2-
四核:NH3、H3O+
五核:CH4、NH4+
它们之间能发生如下反应:A+B=C+D;推断A为NH4+,B为OH-,C为NH3,D为H2O,如果将B、D、E 混合B少量则有白色沉淀,B过量则无沉淀,说明沉淀溶解在B(OH-)中,推断E为Al3+;
(1)化学符号表示下列4种微粒为:A为NH4+,B为OH-,C为NH3,D为H2O;故答案为:NH4+,OH-,NH3,H2O;
(2)B、D、E 混合B过量时的离子方程式为:Al3++4OH-═AlO-+2H2O;故答案为:Al3++4OH-═AlO-+2H2O;
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F、G、H、I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白色烟雾;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是____,②中烟雾的化学式是_________;
(2)④中发生反应的化学方程式是____;
(3)⑤中发生反应的化学方程式是____;
(4)C的化学式是____,D的化学式是__________;
(5)⑦中发生反应的化学方程式是____;
(6)H的化学式是____。
参考答案:(1)HCl;NH4Cl
(2)Cu+Cl2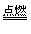 CuCl2
CuCl2
(3)2Mg+CO 2MgO+C
2MgO+C
(4)NO;O2
(5)2H2S+3O2 2SO2+2H2O
2SO2+2H2O
(6)CH4
本题解析:
本题难度:一般
3、填空题 (5分)在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体、B为金属单质,D、E、M是常见气体单质,其中M为黄绿色,N是胃酸主要成分,工业上用E和M来制取N,试推断:
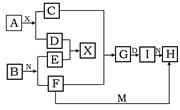
(1)写出下列化学式? A??I?
(2)G转化为I的现象为?
(3)F+M→H离子方程式为?
(4)A+X→C+D的化学方程式为________________________
参考答案:(1)Na2O2、Fe(OH)3。(2)白色沉淀迅速转化为灰绿色,最后转化为红褐色。
(3)2Fe2++Cl2=2Fe3+?(4)2Na2O2+2H2O=4NaOH+O2↑
本题解析:M为黄绿色,则M是氯气,N是胃酸主要成分,则N是氯化氢。A为淡黄色固体,因此A是过氧化钠。B为金属单质,则E是氢气,F和氯气可以继续反应,说明B是变价金属,即为铁,所以F是氯化亚铁。H是氯化铁。D和氢气反应,所以D是氧气。X是水,C是氢氧化钠,G是氢氧化亚铁,I是氢氧化铁。
本题难度:一般
4、填空题 (8分)A、B、C、D、E、F、G七种物质中,其中A、D、E为单质,且D、E为气态,G为液态,它们之间存在如下转化关系:
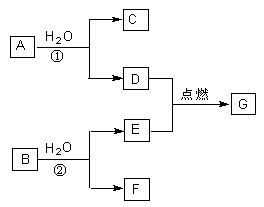
(1)当A、B的质量相等时,生成的D和E恰好完全反应,则C的电子式是?;反应②的离子方程式是 ?。
?。
(2)当A、B的质量比为38:21时,生成的D和E的物质的量之比为1:2,且恰好完全反应,则B的电子式为?;反应①的化学方程式是??。
参考答案:

本题解析:略
本题难度:一般
5、填空题 (8分)甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:

(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素。则含有7个中子的核素A可用符号表示为?,丁溶液呈碱性的原因用离子方程式表示为?。
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造?,写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式?。
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件与氧气反应生成乙。若丁是稀盐酸,则乙→丙的化学方程式为?。
参考答案:(8 分)(少条件和↑↓扣1分,不重复扣分)
(1)136C(1分)? CO32—+ H2O HCO3?+ OH—(2 分)(没可逆不得分)
HCO3?+ OH—(2 分)(没可逆不得分)
(2)光导纤维(1 分);? Na2SiO3 + H2O + CO2 ="=" H2SiO3↓+ Na2CO3(2 分)
(3) Fe3O4 + 8 HCl="=" 2FeCl 3 + FeCl 2+ 4 H2O(2 分)
本题解析:推断题首先要找准突破口,“甲是单质”是本题的一个题眼,乙是一种氧化物。
(1)温室气体同时是氧化物的是二氧化碳,则甲是C,乙是CO2,丁能与乙反应同时含有A元素,说明丁含有CO32—,丙含有HCO3?,表示核素要把体现该原子的质量数,核素A是136C或13C,碳酸盐呈碱性的原因是碳酸根离子的水解造成的:CO32—+ H2O HCO3?+ OH—
HCO3?+ OH—
(2)次外层电子是最外层电子数的2倍得出是Si,则乙是二氧化硅,丁可以是氢氧化钠,丙就是硅酸钠。证明元素的非金属性强弱,可以先比较对应最高价氧化物的水化物的酸性强弱,如果碳酸可以生成硅酸,说明碳酸的酸性强于硅酸,进一步证明C的非金属性强于Si。
(3)最常用的过渡金属单质就是铁,点燃条件下生成的是Fe3O4而不是Fe2O3,要注意区分。
点评:本题属于比较综合的试题,考查点多,需要学生结合所学知识进行分析、推理并能利用所学理论进行解释,难度中等。
本题难度:一般