微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分) A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
的单质是生活中常见的金属,相关物质间的关系如下图所示。

(1)X的单质与A反应的化学方程式是______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是________________________________________
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_______________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________________________________。
参考答案:(1)Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(2)2Al+2H2O+2OH-===2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+
②Al3++3H2O? ?Al(OH)3+3H+
?Al(OH)3+3H+
③2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑(3分)
本题解析:(1)元素X、Y的单质是生活中常见的金属,且X能置换出Y,则X是铝,Y是铁。则A是氧化铁,Y是氧化铝。所以X的单质与A反应的化学方程式是Fe2O3+2Al Al2O3+2Fe。
Al2O3+2Fe。
(2)铝能与氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2H2O+2OH-===2AlO+3H2↑。
(3)①若试剂1和试剂2均是稀硫酸,则D是氯化铁。检验铁离子的试剂是KSCN溶液,因此方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+。
②铝离子在水溶液中水解生成氢氧化铝和氢离子,从而溶液显酸性,方程式是Al3++3H2O? ?Al(OH)3+3H+。
?Al(OH)3+3H+。
③根据反应物和生成物可知,反应的方程式是2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑。
本题难度:一般
2、填空题 三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:F中的溶质 ______________; 丙____________。反应③离子方程式?
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________A与水反应的离子方程式?。
参考答案:(1)FeCl2;HCl。?(2)2 Fe2++Cl2 2Fe3++2Cl―
2Fe3++2Cl―
(3)2Al+Fe2O3 2Fe+Al2O2?(4)2Na+2H2O
2Fe+Al2O2?(4)2Na+2H2O 2Na++2OH-+H2↑
2Na++2OH-+H2↑
本题解析:框图推断题要注意寻找解题的突破口,在本题中,焰色反应为黄色说明物质中一定含有钠元素,黄绿色的气体是氯气,钠和水反应生成氢气和氢氧化钠,红褐色的沉淀一定是氢氧化铁,根据物质的性质来完成此图物质间的转化即可.A的焰色反应为黄色,所以A一定是金属钠,钠和水反应生成氢气和氢氧化钠,甲是氢气,D的溶液是氢氧化钠,气体丙是氯化氢,所以E是盐酸,红褐色的沉淀H一定是氢氧化铁,所以金属C是铁,F是氯化亚铁,能和氢氧化钠反应生成氢气的金属只有铝,所以B是铝.
本题难度:一般
3、简答题 下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去).已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂.据此回答以下问题:
(1)单质A必定是______(填“金属”或“非金属”),理由是______.
(2)写出反应①的化学方程式______.并指出该反应在现代化学工业上的实际意义______.
(3)物质B的分子空间构型为______.
(4)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为______.
(5)写出反应③的离子方程式______.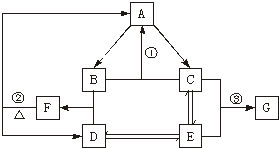
参考答案:(1)因为B+C→A+X,X为不含R元素的另一物质,A为单质,因此A元素在B、C中应分别呈正负价,所以A为非金属,
故答案为:非金属;因为B+C→A+X,X为不含R元素的另一物质,且A为单质,因此,A元素在B、C中应分别呈正、负价,所以A是非金属;
(2)由于F可用作化肥,也可用作炸药,则F为NH4NO3;由F?△?.?A(单)+D,B+D→F知,D为HNO3,B为NH3,A为N2;又因含氮元素的物质G可用作防腐剂和抗冻剂,则G为NaNO2;结合A→C可知C为NO,E为NO2,反应①的方程式为4NH3+6NO=5N2+6H2O.该反应可用于治理NO对大气的污染,
故答案为:4NH3+6NO=5N2+6H2O;用于治理NO对大气的污染;
(3)氨气分子的空间构型为三角锥型,故答案为:三角锥型;
(4)反应②的化学反应方程式为5NH4NO34N2+2HNO3+9H2O,其中有5?mol?NH3化合价升高生成N2,有3?mol?HNO3化合价降低生成N2,故氧化产物与还原产物的物质的量之比为5:3,故答案为:5:3;
(5)NO、NO2与碱反应的离子方程式为NO2+NO+2OH-=2NO2-+H2O,故答案为:NO2+NO+2OH-=2NO2-+H2O.
本题解析:
本题难度:一般
4、填空题 (14分)下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)
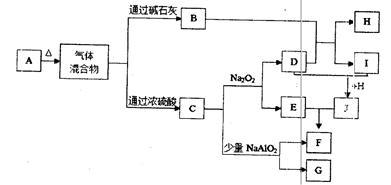
(1)若A加热后得到等物质的量的B和C,则A的化学式为?。
(2)实验室检验B的方法是?。
(3)写出上述由I生成J的化学方程式?。
(4)写出C和少量NaAlO2溶液反应的离子方程式?。
(5)由H所含的两种元素组成的18电子微粒的电子式为?。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择?(填代号);
A.石灰石?B.稀HNO3?C.稀H2SO4?D.稀HCl? E.纯碱
所需气体发生装置是?(填代号);所选装置中涉及到的玻璃仪器的名称为?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 (14分)下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。
 ?
?
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功制取的方法_________________________________
参考答案:(1)Fe(OH)3,制造盐酸、漂白剂、农药、合成纤维、消毒杀菌等
(2)2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑
(3) KSCN(其它合理的答案也对)
(4)Fe(OH)2 + 2Fe(OH)3=Fe3O4 + 4H2O,做丁达尔实验,能产生丁达尔现象(其它合理答案也对)。
本题解析:略
本题难度:简单