微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)A、B两元素在周期表中位于同一周期,核电荷数均小于36,最外层均为一个电子,A的次外层为8个电子,B的电子排布式为ls22s22p63s23p63d104s1(或[Ar] 3 dl0
dl0 4s1),则A元素的核外电子排布图为:?;
4s1),则A元素的核外电子排布图为:?;
B的元素符号为____,位于周期表第?周期?族。
参考答案: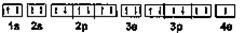
(2分)Cu(2分)、四(2分)、IB(2分)
本题解析:略
本题难度:简单
2、选择题 下列事实不能用来说明Cl非金属性比S强的是
A.气态HCl比H2S稳定
B.HCl酸性比H2SO3强
C.还原性:S2-比Cl-强
D.Cl2通入NaBr溶液中生成Br2
参考答案:BD
本题解析:A 能说明,氯的半径比硫小,非金属性比S强。
B 不能说明,应比较最高价含氧酸的酸性,酸性越强,非金属性越强。
C 能说明,S2-比Cl-强,说明硫离子半径比氯离子半径大,非金属性就弱。
D 不能说明,是比较氯和溴的非金属性,而不是比较氯和硫的非金属性。
本题难度:一般
3、填空题 下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置____________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:___________________________________(写氢化物的化学式 )。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______________________;这一反应是____________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程___________________________。
参考答案:(1)氧或氧元素?第二周期ⅥA族?氧化性? (2)PH3<H2S<H2O
(3) 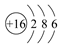
(4)2Na+O2 Na2O2?放热
Na2O2?放热
(5)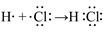
本题解析:元素④是处在第二周期,第ⅥA族,是氧元素。在元素周期表中,同一周期中,从左到右,元素的非金属性越来越强,氧化性越来越强,元素对应的氢化物稳定性也越来越好,而同一主族中,从上到下,元素的非金属性越来越弱,元素对应的氢化物稳定性也越来越差,故稳定性:PH3<H2S<H2O。
(3)元素⑦是硫元素,其原子结构示意图为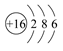 。
。
(4)元素⑤处在第三周期第ⅠA,判断为Na,在氧气中燃烧的化学方程式为2Na+O2 Na2O2?该反应为放出大量的热量,为放热反应。
Na2O2?该反应为放出大量的热量,为放热反应。
(5)首先根据①与⑨在元素周期中的位置快速判断两者分别为H和Cl,两者形成HCl,其电子式形成方程为: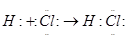
点评:本题综合性较强,涵盖了必修2第一章的全部知知识,但难度不大,侧重对学生基础知识的巩固。
本题难度:一般
4、填空题 A、B、C三种元素为短周期元素,A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为___________,它是___________离子。1 mol B单质能从盐酸中置换出3 g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是___________;B的最高价氧化物对应水化物的化学式为___________。C元素有3个电子层,且最外电子层比L层少2个电子,则C元素是___________;C与Na反应后生成物的电子式为___________,化合物中的化学键属于___________。
参考答案: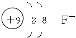 ?铝? Al(OH)3?硫
?铝? Al(OH)3?硫
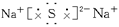 ?离子键
?离子键
本题解析:A元素的阴离子不能被任何氧化剂氧化,说明A元素是非金属性最强的元素,则A为氟元素,其阴离子即为F-,结构示意图为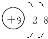 。
。
n(H2)=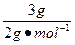 =1.5mol,因为
=1.5mol,因为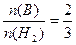 ,所以B为+3价的金属,又因B转变为与Ne原子的电子层结构相同的离子,则B元素为铝元素;由题意知C元素原子的最外层(M层)上有6个电子,故C为硫元素,它与钠反应后生成离子化合物硫化钠,含有离子键,其电子式为
,所以B为+3价的金属,又因B转变为与Ne原子的电子层结构相同的离子,则B元素为铝元素;由题意知C元素原子的最外层(M层)上有6个电子,故C为硫元素,它与钠反应后生成离子化合物硫化钠,含有离子键,其电子式为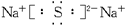 。
。
本题难度:简单
5、选择题 俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为115288X。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素115288X的质量数与中子数之差为173
C.113号元素属于非金属元素
D.115号元素的最高正化合价是 +5
参考答案:D
本题解析:A、115号元素衰变成113号元素没有新物质生成,不属于化学变化,错误;B、核素115288X的质量数与中子数的差值即为质子数为115,错误;C、113号元素位于第七周期第三主族,为金属元素,错误;D、115号元素位于第七周期第五主族,最高价为+5,正确,答案选D。
本题难度:一般