微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为
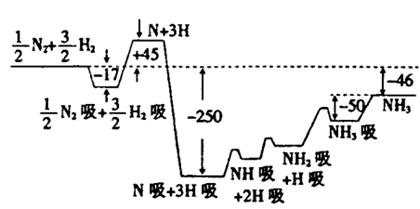
①?
②N2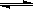 N2吸
N2吸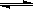 ?2N
?2N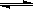 2N吸
2N吸
③N吸+H吸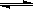 NH吸
NH吸
④NH吸+H吸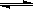 NH2吸
NH2吸
⑤NH2吸+H吸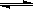 NH3吸
NH3吸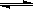 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为?。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3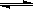
 +
+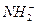 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。
参考答案:(1)①H2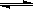 H2吸
H2吸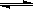 2H
2H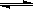 2H吸(2分)
2H吸(2分)
(2)N2(g)+3H2(g)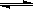 2NH3(g)△H=-92kJ·mol-1(3分)
2NH3(g)△H=-92kJ·mol-1(3分)
(3)15(3分)
(4)N2H62++H2O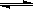 [N2H5·H2O]++H+(2分)
[N2H5·H2O]++H+(2分)
本题解析:略
本题难度:简单
2、简答题 已知A(g)+B(g)?C(g)+D(g)?反应过程中的能量变化如图所示,回答下列问题.
(1)该反应是______反应(填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是______,(填“增大”、“减小”或“不变”)理由是______;?E的大小对该反应的反应热有无影响?______.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1mol?A(g)?和3mol?B(g),判断该反应达到平衡状态的依据是(填序号)______.
①c?(A)=c?(C)?②容器中压强不变
③混合气体的平均相对分子质量不变?④v(逆)(D)=v?(正)(B)
(4)在某温度下,反应物的起始浓度分别为:c(A)=1mol?L-1,c(B)=2.4mol?L-1,达到平衡后,A的转化率为60%,此时B?的转化率为______.
(5)若反应温度不变,反应物的起始浓度分别为:c(A)=4mol?L-1,c(B)=amol?L-1,达到平衡后,c(C)=2mol?L-1,列出计算式并求出a值.
参考答案:(1)由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应.
升高温度平衡向吸热反应移动,即向逆反应移动,A的转化率减小.
故答案为:放热;减小.
(2)催化剂改变了反应的历程降,低活化能,加快反应速率,反应热取决于反应物总能量与生成物的总能量,催化剂不能影响反应热.
故答案为:减小;?因为催化剂改变了反应的历程使活化能E降低;?无影响.
(3)①平衡时A、C浓度可能相等,但c?A)=c(C)不能说明反应到达平衡,故①错误;
?②由方程式可知,反应前后气体体积不变,恒容下压强不发生变化,故②错误;
③混合物的总质量不变,总的物质的量不变,混合气体的平均相对分子质量始终不变,故③错误;
?④v(逆)(D)=v?(正)(B),速率之比等于化学计量数之比,说明反应到达平衡,故④正确.
故选:④.
(4))△c(A)=60%×1mol?L-1=0.6mol?L-1,浓度变化量之比等于化学计量数之比,所以△c(B)=△c(A)=0.6mol?L-1,故此时B的转化率0.6mol/L2.4mol/L×100%=25%.
故答案为:25%
(5)由(4)可知平衡时,各物质的浓度为c(A)=0.4mol/L,c(B)=2.4mol/L-0.6mol/L=1.8mol/L,c(C)=c(D)=△c(B)=△c(A)=0.6mol/L,所以平衡常数k=0.6×0.60.4×1.8=12.
反应物的起始浓度分别为:c(A)=4mol?L-1,c(B)=amol?L-1;达到平衡后,c(C)=2mol?L-1,则生成的D为2mol?L-1,平衡时c(A)=2mol?L-1,c(B)=(a-2)mol?L-1;
温度不变,则平衡常数不变,则2×22×(a-2)=12,a=6.
故答案为:6.
本题解析:
本题难度:一般
3、选择题 下列说法中①物质发生化学反应都伴随着能量变化;②伴有能量变化的物质变化都是化学变化;③酸和碱发生中和反应生成1mol水时所释放的热量称为中和热;④H20比H2S
的沸点高是因为H20中含有的化学键比 H2S强;⑤Al与稀盐酸反应是放热反应;⑥
Ba(OH)2.8H2O晶体与NH4Cl固体的反应是放热反应;⑦CaCO3受热分解是吸热反应;?⑧
CaO与水的反应是放热反应;⑨放热反应在常温下一定很容易发生,其中正确的组合(?)
A.①②⑤⑥⑦⑩
B.①③⑤⑦⑧
C.①④⑤⑦⑧⑨
D.①③⑤⑥⑦⑧⑨
参考答案:B
本题解析:化学变化的特征之一就是伴随着能量的变化,但伴随能量变化的不一定是化学变化,①正确,②不正确。③是中和热的概念,正确。水的沸点高于H2S的是因为水分子着存在氢键,化学键才是影响物质稳定性的因素,④不正确。金属与酸的反应一般是放热反应,⑤正确,⑥不正确,反应是吸热反应。分解反应一般是吸热反应,⑦正确。生石灰溶于水生成氢氧化钙属于放热反应,⑧正确。反应是放热反应还是吸热反应与反应条件无关,⑨不正确。所以答案是B。
本题难度:一般
4、选择题 下列反应中,生成物的总能量大于反应物的总能量的是
A.氢气在氧气中燃烧
B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧
D.铁丝在氧气中燃烧
参考答案:B
本题解析:生成物的总能量大于反应物的总能量,该反应是吸热反应。所有的燃烧反应都是放热反应,焦炭在高温下与水蒸气反应是吸热反应,答案选B。
本题难度:简单
5、选择题 某化学反应中产物的总能量为60kJ,如果该反应是放热反应,那么反应物总能量可能是( )
A.50kJ
B.30kJ
C.80kJ
D.20kJ
参考答案:因放热反应中,反应物的总能量高于生成物的总能量,产物的总能量为60kJ,所以反应物总能量大于60kJ,
故选C.
本题解析:
本题难度:简单