|
高考化学知识点总结《弱电解质电离平衡》试题预测(2017年最新版)(十)
2017-07-27 10:37:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示。横轴为加入氢氧化钠的体积数,纵轴为溶液的pH。下列正确的是
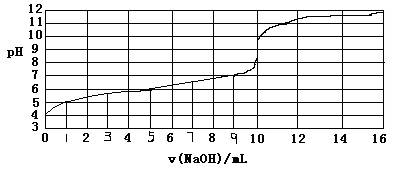
A.此一元弱酸的电离常数(Ka)约为1.0×10-6
B.此弱酸的浓度为1×10-4mol/L
C.此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂
D.此滴定反应为吸热反应
|
参考答案:A
本题解析:由图象可知,起始酸的pH为4,故c(H+)=10-4mol/L,故酸的浓度必大于10-4mol/L,B项错误;此滴定终点为pH=10,溶液显碱性而甲基红变色范围4.2~6.3,显酸性,故应选择酚酞作指示剂,故C项错误;酸碱中和反应为发热反应,故D项错误;设一元酸为HA,由图可知当加入NaOH溶液5ml时溶液溶质恰好为HA、NaA物质的量之比1:1的混合物,故Ka=  1.0×10-6,故A项正确;本题选A。 1.0×10-6,故A项正确;本题选A。
考点:酸碱中和滴定。
本题难度:一般
2、选择题 氢氟酸为弱酸。250C时将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是
①n(H+);②c(H+)·c(OH—);③c(OH—)+ c(F—);④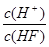 ;⑤ ;⑤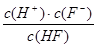 ; ;
A.①③④
B.②③④
C.③④⑤
D.②⑤
参考答案:D
本题解析:①n(H+)随着加水的量会逐渐的增大,因为弱电解质的电离会随浓度的减小而增大; ②c(H+)·c(OH—)这是水的离子积常数,只随温度的变化而变化;③c(OH—)+ c(F—),依据电花守恒可知c(OH—)+ c(F—)=c(H+),但是氢离子的浓度是一直在变化的,所以这个值是个变化的值;④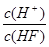 ?无法确定;⑤ ?无法确定;⑤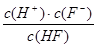 这是平衡常数,是个定值;因此选D。 这是平衡常数,是个定值;因此选D。
本题难度:一般
3、填空题 A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1?xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;②浓度均为0.1mol·L-1A和E溶液,pH:A<E;③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是?溶液,判断理由是?。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是?(填写序号)。
①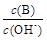 ?② ?②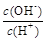 ?③c(H+)和c(OH-)的乘积?④OH-的物质的量 ?③c(H+)和c(OH-)的乘积?④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A?②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E?④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余?⑥E溶液里有锌粉剩余
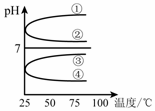
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
参考答案:
(1)NaOH?中和酸性物质A只有NaOH、NH3·H2O,一定物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH(3分)
(2)①②?(3)③④⑤(3分)?(4)④?(5)c(Na+)> c(SO42-)>c(NH4+)>c(OH-)=c(H+)
本题解析:中和酸性物质A只有NaOH、NH3·H2O,一定物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以B是NH3·H2O,D是NaOH。浓度相同的C与NaOH溶液等体积混合,溶液呈酸性,说明C是NH4HSO4。浓度相同A和E溶液,pH:A<E,说明A是HCl,E是CH3COOH。(2)在NH3·H2O中存在电离平衡NH3·H2O NH4++OH-,加水稀释弱电解的电离平衡向正向进行,故①②正确。(3)有上知,A为盐酸,B为醋酸,OH-浓度相同的等体积的两份溶液A和E,说明A和E的pH相同,故二者c(H+)相同,故开始时的反应速率相同,随反应的进行c(H+)减小,而醋酸中c(H+)减小的慢。PH相同的醋酸和盐酸,醋酸的物质的量多,故盐酸完全反应,A中锌粉有剩余;由于产生的氢气一样多,故参加反应的锌粉相同。(4)等体积、等物质的量浓度B和C混合后的溶液为NH4SO4其水解显酸性,升温水解平衡正向移动,c(H+)增大,pH减小,故选④;(5) NH4++OH-,加水稀释弱电解的电离平衡向正向进行,故①②正确。(3)有上知,A为盐酸,B为醋酸,OH-浓度相同的等体积的两份溶液A和E,说明A和E的pH相同,故二者c(H+)相同,故开始时的反应速率相同,随反应的进行c(H+)减小,而醋酸中c(H+)减小的慢。PH相同的醋酸和盐酸,醋酸的物质的量多,故盐酸完全反应,A中锌粉有剩余;由于产生的氢气一样多,故参加反应的锌粉相同。(4)等体积、等物质的量浓度B和C混合后的溶液为NH4SO4其水解显酸性,升温水解平衡正向移动,c(H+)增大,pH减小,故选④;(5)
本题难度:困难
4、选择题 下列公式中哪一个能用来精确地计算任意浓度[c(HCl)]的HCl水溶液中氢离子浓度
[c(H+)](Kw为水的离子积常数) ?(?)?
A.c(H+)="c(HCl)"
B.c(H+)=c(HCl)+Kw/c(H+)
C.c(H+)=c(HCl)+Kw
D.c(H+)=c(HCl)?Kw/c(H+)
参考答案:B
本题解析:HCl溶液中氢离子的浓度是由HCl电离产生的氢离子浓度加上水电离产生的氢离子浓度,而任何水溶液中水电离的氢离子等水电离的氢氧根,在HCl溶液中OH-都来自于水的电离,由c(H+)·c(OH-)=KW,计算出溶液中c(OH-)=Kw/c(H+)=c(H+)水
本题难度:一般
5、填空题 (9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是?。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式?;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中??沉淀生成(填“有” 或“无”)。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)∕c(CO32-)=20/9,其原因是?;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO32-)=5∕2,其原因是?。(用离子方程式和必要的文字说明)
参考答案:

本题解析:略
本题难度:一般
|