微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知: 3/2CO2(g)+2Fe(s) = Fe2O3(s)+3/2C(s)?△H=-234.1kJ·mol-1
CO2(g) = C(s)+O2(g)?△H=+393.4kJ·mol-1。
则2Fe(s)+3/2O2(g)=Fe2O3(s)的△H是?
A.-824.2kJ·mol-1
B.-627.5kJ·mol-1
C.+861.6kJ·mol-1
D.+159.3kJ·mol-1
参考答案:A
本题解析:CO2(g) = C(s)+O2(g)?△H=+393.4kJ·mol-1知C(s)+O2(g)= CO2(g) △H=-393.4kJ·mol-1则3/2C(s)+3/2O2(g)="3/2" CO2(g) △H=-393.4kJ·mol-1*3/2=-590.1kJ·mol-1该式与所给一式相加得2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-824.2kJ·mol-1故选A。
本题难度:简单
2、选择题 下列五个化学方程式:
① C2H2(g) + H2(g)  C2H4(g);?② CH4(g)
C2H4(g);?② CH4(g)  ?H2(g) + C2H4(g),
?H2(g) + C2H4(g),
③ C(s) + 2H2(g)  CH4(g);△H=-x KJ· mol-1,
CH4(g);△H=-x KJ· mol-1,
④ C(s) + H2(g) 1/2C2H2(g);△H=-y KJ· mol-1,
1/2C2H2(g);△H=-y KJ· mol-1,
⑤ C(s) + H2(气)=1/2C2H4(g);△H=-z KJ· mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③至⑤式中x、y、z的大小顺序正确的是(? )
A.x >y>z
B.x>z>y
C.y>x>z
D.z
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列设备工作时,将化学能转化为热能的是
?
参考答案:D
本题解析:本题以生活材料为背景考查能量转化知识。硅太阳能电池是将太阳能转化为电能的装置,A 不合题意;锂离子电池是将化学能转化为电能的装置,B不合题意;太阳能热水器是将太阳能转化为热能的装置,C不合题意;燃气灶是将化学能转化为热能的装置,D符合题意。
【考点定位】以新材料为背景,考查化学反应与能量的关系。
本题难度:一般
4、选择题 已知:H+ (aq)+OH- (aq)= H2O?△H1 =" -" 57.3 kJ·mol-1,
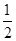 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=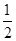 Na2SO4(aq)+ H2O(l)?△H2 = m,下列说法正确的是(?)
Na2SO4(aq)+ H2O(l)?△H2 = m,下列说法正确的是(?)
A.上述热化学方程式中的计量数表示分子个数
B.△H1>△H2
C.△H2 =" -" 57.3 kJ·mol-1
D.|△H1|>|△H2|
参考答案:B
本题解析:
【错解分析】此题旨在考查对“热化学方程式的意义”的理解和对“中和热”概念的掌握,属于容易题。
【正解】热化学方程式中的化学计量数表示物质的量,A项不对;浓H2SO4在稀释时放热,含0.5 mol H2SO4的浓H2SO4与1 mol NaOH反应放出的热量应等于浓硫酸稀释时放出的热量和中和热之和,因此,△H2 < △H1 < 0,且|△H1| > |△H2|。
本题难度:简单
5、填空题 (13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
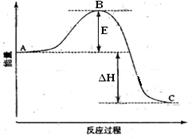
 (1)图中A、C分别表示?、?
(1)图中A、C分别表示?、?
(2) E的大小对该反应的反应热有无影响??。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低??
 (3)图中△H=?KJ·mol-1;
(3)图中△H=?KJ·mol-1;
 (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
??、??
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H?(要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H?(要求写出计算过程)。
参考答案:(1)反应物能量?生成物能量
(2)无?降低?因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4)SO2+V2O5=SO3+2VO2? 4VO2+O2=2V2O5?0.025? 0.05
(5)-1185kJmol-1
本题解析: (1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2? 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比计算即可。
(5)根据题意①S(s)+O2(g) =SO2(g)? △H= —296KJ/mol,又因为②SO2(g)+1/2O2(g) =SO3(g)? △H= —99kJ/mol。根据盖斯定律可知①+②即得到S(s)+3/2O2(g) =SO3(g)? △H= —395KJ/mol,所以由S(s)生成3 molSO3(g)的△H=—395KJ/mol×3=-1185kJmol-1。
本题难度:一般