微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)

2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______.
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化?②容器内压强不再发生变化?③容器内气体原子总数不再发生变化?④相同时间内消耗2n?molSO2的同时生成n?molO2?⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
(5)若以如图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.

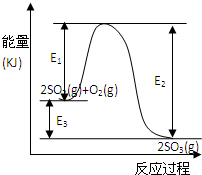
参考答案:(1)△H=反应物吸收的能量-生成物放出的能量═-E3kJ/mol=-(E2-E1)kJ/mol,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
(2)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应.
? 2SO2(g)+O2(g)?2SO3(g)?放热 E3?
? 反应开始?3 mol? 1mol? 0? E3
? 转化?1.8 mol? 0.9mol? 1.8 mol? 0.9E 3
? 平衡?1.2mol? 0.1mol? 1.8 mol?
? 所以SO2的转化率=1.8mol?3mol×100%=60%
放出热量 0.9E 3
故答案为:60%;放出; 0.9 E3;
(3)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等、体系各物质的含量不变.
①②④符合条件;根据原子守恒,各元素的原子总数始终不变,故③错;⑤所指方向一致,故⑤错.
故选:①②④;
(4)加入催化剂,改变了反应历程,改变反应速率,但平衡不移动,所以E2、E1 减小,E3不变,
故答案为:E2、E1 减小,E3不变;
(5)根据原电池反应原理,还原剂在负极上发生氧化反应电极反应式为SO2-2e-+2H2O═SO42-+4H+;,氧化剂在正极上发生还原反应电极反应式为O2+4e-+4H+═2H2O,该原电池的本质是2SO2+O2+2H2O=2H2SO4,为维持浓度不变,SO2和O2反应生成硫酸的质量分数是50%,所需的水为反应反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:+:O2+4e-+4H+═2H2O,-:SO2-2e-+2H2O═SO42-+4H+; 16:29;
(6)SOCl2中S的化合价是+4价,是中间价态,能发生氧化还原反应,反应中有二氧化硫生成,也有S单质生成,电池反应式为2SOCl2+4e-═S+SO2↑+4Cl-,
故答案为:2SOCl2+4e-═S+SO2↑+4Cl-.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是( )
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L ̄1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等
参考答案:A、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故A错误;
B、硫酸钙微溶,加入碳酸钠溶液可以生成碳酸钙,实现沉淀转化,加酸除去,故B正确;
C、氢氟酸是弱酸存在电离平衡,加水稀释促进电离,c(H+)/c(HF)比值增大,平衡常数制随温度变化,所以稀释溶液平衡常数不变,故C错误;
D、电解精练铜时,阳极泥中常含有金属金、银等不活泼金属,锌在阳极失电子发生氧化反应,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与CL2生成1 mol HCL总的过程需要?(?)
A.放热185kJ
B.吸热185kJ
C.放热92.5kJ
D.吸热92.5kJ
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列说法错误的是
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质的燃烧一定是放热反应
C.放热的化学反应不需要加热就能发生
D.化学能与光能之间可以相互转化
参考答案:C
本题解析:化学反应除了生成新的物质外,还伴随着能量的变化,这是化学反应的特征,A正确;燃烧一定是放热反应,B正确;反应是放热反应还是吸热反应与反应条件无关系,C不正确;化学能与光能之间可以相互转化,例如次氯酸见光易分解等,D正确,答案选C。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确反应热的含义以及影响反应热大小因素、化学反应的特征是答题的关键,注意相关知识的积累和总结,并能熟练记住和灵活运用即可。
本题难度:简单
5、填空题 (共18分)I(6分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
?
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
?
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
?
II.(12分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应; 如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。

(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:

①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。
参考答案:(18分)I(1)1/2N2(g)+3/2H2(g)=NH3(g)?△H=-46.1 kJ·mol-1
(2)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(l);△H=-1366.8 kJ·mol-1
(3)C(石墨s)+H2O(g)="=" CO(g)+ H2(g);△H=131.3 kJ·mol-1(每空2分)
II(1)放出?吸热?放热?(2)①化学?电?②负?(每空2分)
本题解析:略
本题难度:一般