微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢的不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
参考答案:A、目前我国流通的硬币是由合金材料制成:1角的为不锈钢,5角的为钢芯镀铜,1元的为钢芯镀镍,故A选项正确;
B、生铁含碳量最高,普通钢次之,不锈钢最少.题目说法与事实相反,故B选项说法错误.
C、制造照明弹就是利用了镁燃烧发出耀眼的白光,故C选项正确;
D、铝表面覆盖致密的氧化物薄膜,对金属起保护作用,故D选项正确.
故选B.
本题解析:
本题难度:一般
2、简答题 (14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
装 置
| 现 象
|
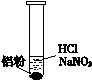
| ⅰ. 实验初始,未见明显现象
ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色
ⅲ. 试管变热,溶液沸腾
|
?
① 盐酸溶解Al2O3薄膜的离子方程式是______。
② 根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实?验
| 内?容
| 现?象
|
实验1
| ?将湿润KI—淀粉试纸置于空气中
| 未变蓝
|
实验2
| 用湿润KI—淀粉试纸检验浅棕色气体
| 试纸变蓝
|
?a. 浅棕色气体是______。
b. 实验1的目的是_______。
c. 实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
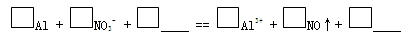
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
装 置
| 现 象
|
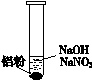
| ⅰ. 实验初始,未见明显现象
ⅱ. 过一会儿,出现气泡,有刺激性气味
|
?
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是______。
② 产生该气体的离子方程式是______。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是______。
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
参考答案:(14分)
(1)还原性
(2)① 6H+ + Al2O3 ="=" 2Al3+ + 3H2O
② a.NO2
b. 对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能
c. 1,1,4H+,1,1,2H2O
(3)① NH3
② 8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-
(4)2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑
本题解析:(1)加入铝粉产生H2,说明铝具有还原性;
(2)① 盐酸溶解Al2O3薄膜,生成氯化铝和水,离子方程式为6H+ + Al2O3 ="=" 2Al3+ + 3H2O
②a.、浅棕色气体是NO2
b、实验1的目的是与实验2作对比,排除实验2中氧气使湿润的淀粉KI试纸变蓝的可能;
c、根据所学知识,Al与硝酸反应生成NO,所以反应物的空白应填写“H+”,所以产物中应有水存在,再根据得失电子守恒法、观察法配平方程式即可。配平后的离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O
(3)①用湿润红色石蕊试纸检验,试纸变蓝。则使湿润红色石蕊试纸变蓝的气体是NH3;
② 该反应有氨气产生,说明Al与氢氧化钠溶液、硝酸钠溶液发生了氧化还原反应,离子方程式为:8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-;
(4)Al与单一氢氧化钠溶液反应的化学方程式是2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑。3-的氧化性的判断,氨气的检验,化学方程式、离子方程式的书写
本题难度:一般
3、选择题 在托盘天平右盘上放一只盛有100 mL3 mol/LNaOH溶液的烧杯,左盘上放一只盛有100 mL3 mol/L盐酸的烧杯,调节天平到平衡,然后在两烧杯中各加入等量的铝片, 反应完全后,则天平可能出现的情况是
[? ]
A.左盘下沉
B.右盘下沉
C.仍保持平衡
D.无法判断
参考答案:AC
本题解析:
本题难度:简单
4、填空题 (1)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的化学方程式_________________________
(2)明矾是一种无色晶体,可溶于水并形成Al(OH)3胶体来净水。已知明矾水溶液的主要成分是
KAl(SO4)2,现向明矾溶液中逐滴加入Ba(OH)2溶液,当Al3+恰好全部沉淀时,试写出该反应的化学方程式
_________________________。
参考答案:(1)NaHSO4+Ba(OH)2==BaSO4↓+H2O+NaOH
(2)2KAl(SO4)2+3Ba(OH)2==3BaSO4↓ + Al(OH)3↓+K2SO4
本题解析:
本题难度:一般
5、实验题 (12分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)向滤液中通入过量CO2所发生反应的离子方程式为?。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为?。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
参考答案:(12分)
(1) AlO2— +2H2O +CO2=Al(OH)3↓+HCO3—(2分)
(2)Fe2O3+2Al Al2O3+2Fe(2分)
Al2O3+2Fe(2分)
(3)HCl和AlCl3 (2分)? NaCl(2分)
(4)Al-3e-+4Cl-= AlCl4-(2分)
(5)表面形成的致密氧化铝膜能防止钢材腐蚀,或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离?(2分)
本题解析:(1)滤液中含有AlO2— ,通入CO2,生成Al(OH)3沉淀,离子方程式为:AlO2— +2H2O +CO2=Al(OH)3↓+HCO3—
(2)铝在高温条件下,把Fe2O3还原为Fe,化学方程式为:Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(3)因为粗铝中含有氢气,所以与Cl2反应生成AlCl3和H2,AlCl3在181℃升华,所以气泡的主要成分除Cl2外还含有HCl和AlCl3;粗铝中含有Na,与Cl2反应生成NaCl,NaCl熔点为801℃,所以浮渣中肯定存在NaCl。
(4)Al失电子生成AlCl4-,电极方程式为:Al-3e-+4Cl-= AlCl4-
(5)Al在空气中与O2反应生成Al2O3,表面形成的致密氧化铝膜,能防止钢材腐蚀。
本题难度:一般