微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物。
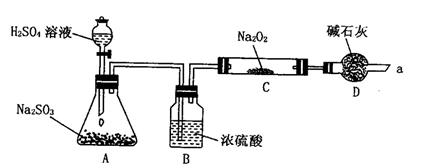
回答下列问题:
(1)装置B的作用___________________________________________________。
装置D除了吸收过量的SO2外还有什么作用___________________________。
(2)如何检验反应中是否有O2生成______________________________________。
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.
该方案是否合理____________(填是或否),理由是_____________________-。
参考答案:(1)干燥SO2气体,防止较多的水蒸气与Na2O2反应。
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;
(2)用带有余烬的木条靠近干燥管口a,观察其是否燃烧。?
(3)否;HNO3有氧化性,据此不能确定产物是NaSO3还是Na2SO4或者二者兼有
本题解析:(1)A中生成的SO2中含有水蒸气,而水也能与过氧化钠反应,所以需要除去SO2中的水。由于空气中也含有水蒸气和CO2。因此为防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,需要用碱石灰来吸收。
(2)检验氧气一般用带火星的木条靠近干燥管口a,木条复燃即证明有氧气生成。
(3)由于硝酸具有氧化性,可以把溶液亚硫酸钡氧化生成硫酸钡,所以据此不能确定产物是NaSO3还是Na2SO4或者二者兼有。
本题难度:一般
2、实验题 (12分)某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。
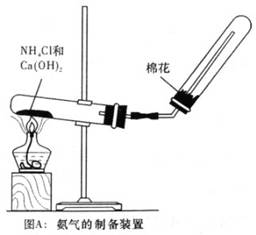
(1)根据图A氨气的制备装置制取氨气,试回答:收集氨气的方法是________________:装置中棉花的作用是_______________。
(2)甲、乙两组同学用干燥的圆底烧瓶各收集一瓶氨气,根据图B喷泉实验的装置进行实验,都观察到美丽的红色喷泉。
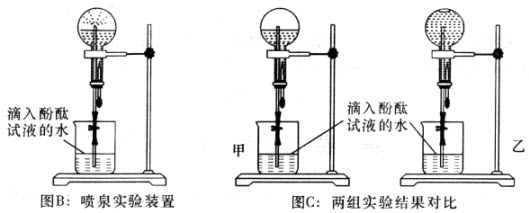
根据实验现象说明氨气具有的性质是____________________________________。
(3)甲、乙两组同学完成喷泉实验后,圆底烧瓶中所得溶液如图C所示。请通过分析确认:甲组同学所得氨水的物质的量浓度_______(填“大于”、“小于”或“等于”)乙组同学所得氨水的物质的量浓度。
参考答案:⑴向下排空气法(2分);防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯氨气(3分)。
⑵极易容于水(2分)、溶于水后溶液呈碱性(2分)。
⑶等于(3分)。
本题解析:考查氨气的制取及性质
(1)由于氨气的密度小于空气,故采用的是向下排空气法;在收集氨气的试管口部塞少许棉花,可防止防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯氨气
(2)喷泉实验的本质是由于在烧杯与烧瓶之间产生了压强差,主要是由于氨气极易溶解于水,烧瓶内压强迅速减小所致;
酚酞在碱性情况下才呈红色,说明氨水呈碱性;
(3)原烧杯中氨气全部溶于水,形成喷泉,溶液的体积也就是原氨气的体积,根据阿伏加德罗定律可知,氨气的体积比等于所得溶液的溶质的物质的量比,也等于溶液的体积比,由物质的量浓度的概念可知,两溶液的浓度相等
本题难度:简单
3、实验题 (15分)某兴趣小组用题27图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
参考答案:
(1)4NH3+5O2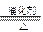 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓硫酸;生成的NO与O2反应生成NO2;NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
(4)I;NH4Cl,与HCl反应生成氧气
本题解析:略
本题难度:简单
4、实验题 (16分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。(相对原子质量Fe:56)
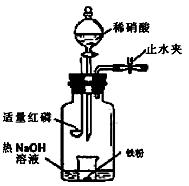
a.向广口瓶内注入足量热NaOH溶液,将盛有a g纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入200mL 6mol/L的稀硝酸,铁粉恰好完全溶解。
(一)气体产物成分探究
①实验前如何检查该装置的气密性?。
②燃烧红磷的目的是?。
③为证明气体产物为NO,步骤c后还缺少的一步主要操作是___________________。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物只有+3价铁;
假设2:?;
假设3:?。
(2)设计实验:分别取小烧杯中反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论:
①若现象为:?,则假设1正确;
②若现象为:?,则假设2正确;
③若现象为:?,则假设3正确。
(3)a值范围为?。
参考答案:(一)①略。(2分)
②除去广口瓶内的氧气,避免干扰气体检验(2分)
③打开止水夹,向瓶内通入少量氧气;(2分)
(二)(1)假设2:产物中只有+2价铁元素(1分)。假设3:产物中既含+2价又有+3价铁元素(1分)。
(2)①甲试管溶液无明显变化,乙试管溶液变红色;(2分)
②甲试管溶液紫色褪去,乙试管没有明显变化;(2分)
③甲试管溶液紫色褪去,乙试管溶液变红色。(2分)
(3)16.8≤a≤25.2 (2分)
本题解析:略
本题难度:一般
5、实验题 某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题:
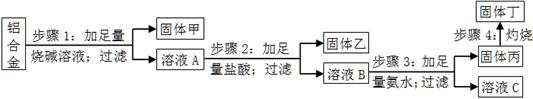
(1)步骤1所得固体甲的成分为?。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为?。
(3)步骤3中生成固体丙的离子方程式为?;溶液C中所含有的阳离子符号为?。
(4)步骤4所发生反应的化学方程式为?。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为?;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则?;
b.步骤4中灼烧不充分,则?。
参考答案:(16分)
(1)镁、铜(2分)
(2)通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。(2分)
(3)Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+(3分);Na+、NH4+(2分)
(4)2Al(OH)3 ?Al2O3 + 3H2O(3分)
?Al2O3 + 3H2O(3分)
(5)81.0%(2分);偏小(1分);偏大(1分)
本题解析:(1)镁、铜不与烧碱溶液反应,故固体甲的成分为镁、铜。
(2)氢氧化铝沉淀可以和盐酸反应,而不能和二氧化碳反应,故不采用通入足量二氧化碳的原因是通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。
(3)氢氧化铝沉淀不再与氨水反应,故步骤3中生成固体丙的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+。溶液C中所含有的阳离子符号为Na+、NH4+。
(4)丙是氢氧化铝,故反应方程式为2Al(OH)3 ?Al2O3 + 3H2O。
?Al2O3 + 3H2O。
(5)Al→1/2Al2O3
27g? 51g
m? 15.3g
51g×m=27g×15.3g
解得m=8.1g
故10.0g铝合金中铝的质量分数为81.0%。
a.步骤1中烧碱量不足,Al反应不完,故偏小。
b.步骤1中灼烧不充分,丁的质量将偏大,故铝质量分数测定要偏大。
点评:本题考查学生对实验与操作原理、物质的分离提纯、物质含量的测定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力。
本题难度:一般