微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 ( 16分)某兴趣小组拟利用如下图装置探究验证干燥的Cl2和潮湿的C l2有无漂白性。
l2有无漂白性。

回答下列问题:
(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、?。
A装置中发生反应的化学方程式是?。
F装置中的试剂应为?,作用为?。
(2)按气体从左向右流向将各装置依次连接起来(填接口标号): a?接?,
?接?,?接?,?接?,?接 ?。
?。
(3)通入Cl2后,从集气瓶A、B中 红色布条的现象可得出的结论是?
红色布条的现象可得出的结论是?
?;其中发生的反应的化学方程式为?。
(4)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是?
?。
(5)烧杯E中发生反应的化学方程式为?。
(6)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛4 mol·L-1的NaOH溶液的体积至少应为?mL。
2、填空题 (10分)利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是?
?▲?。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)=? ▲?
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是?▲?。与方法一相比,方法二的优点是? ▲??。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
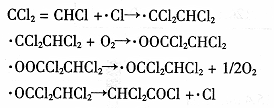
该反应的总化学方程式为? ▲?。
3、实验题 (5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL蒸馏水
| 4 mL 蒸馏水
+3滴浓H2SO4
| 4 mL 蒸馏水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
步骤二:将三支试管振荡后,静置,插入热水浴(约75℃)中,加热约5 min,加热过程中不再振荡。
回答下列问题:
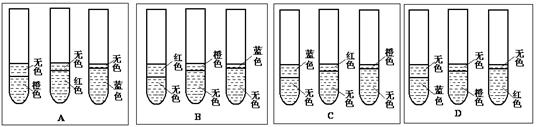
(1)根据你已有的对乙酸乙酯反应条件的认识,该实验预期可观察到的现象是下图中的?。
(2)该实验对反应温度的控制较为严格,若温度过高时,产生的主要问题是?。
(3)在步骤二中,振荡试管后可观察到液体稍显浑浊,其原因是?。
(4)按所设步骤实验反应速率较慢,其主要原因是?。
(5)在实际操作中,针对(4)中的原因进行改进后,预期的现象仍不明显,有人又将该实验作如下改进
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL饱和食盐水
| 4 mL饱和食盐水
+3滴浓H2SO4
| 4 mL饱和食盐水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
实验现象和预期的完全一致。请分析这一改进的主要作用是?。
4、实验题 (12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证?
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液?b.CCl4 ?c.无水酒精?d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
5、填空题 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HC1挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。

(1)若用含有0.2 mol HC1的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是?。
(2)①装置B中盛放的试剂名称为?,作用是?。
装置C中盛放的试剂名称为?,作用是? ?。
?。
②装置D和E中出现的不同现象说明的问题是?。
③装置F的作用是____?。
④写出装置G中发生反应的离子方程式?。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在?与?之间(填装置字母序号),装置中应放入?(填写试剂或用品名称)