|
高考化学必考知识点《化学反应与能量》在线测试(2017年最新版)(二)
2017-07-27 10:56:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是:
A.有机物CH2=CH-CH3中其碳原子杂化类型有sp3和sp2,其中有两个π键,7个σ键
B.分子CO和N2的原子总数相同,价电子总数相等,故性质相似
C.Na+的电子排布式为1s22s22p63s1
D.NO2分子的结构VSEPR模型是直线形
参考答案:B
本题解析:A:CH2=CH-CH3中有8个σ键,1个π键
C:Na+的电子排布式为1s22s22p6
D:NO2分子中心原子上的孤对电子对数为0.5,以1来对待,分子的价层电子对数为3,所以其VSEPR模型是平面三角形,而分子的立体构型为V型。
本题难度:一般
2、选择题 下列说法正确的是
A.物质发生化学变化不一定伴随着能量变化
B.硫酸钡、醋酸铵、氨水都是弱电解质
C.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
D.在温度、压强一定的条件下,自发反应总是向△H-T△S
|
参考答案:
本题解析:
本题难度:一般
3、填空题 (共15分) I(9分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II .(6分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应;如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。

(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:
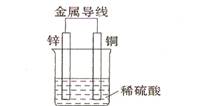
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。[来源:学,科,网]
参考答案:(18分)I(1)1/2N2(g)+3/2H2(g)=NH3(g) △H=-46.1 kJ·mol-1
(2)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(l);△H=-1366.8 kJ·mol-1
(3)C(石墨s)+H2O(g)="=" CO(g)+ H2(g);△H=131.3 kJ·mol-1(每空2分)
II(1)放出 吸热 放热 (2)①化学 电 ②负 (每空1分)
本题解析:
I热化学方程式的书写,注意物质的状态,计量数,吸放热与△H的 “+”“ -”号间关系。
(1)1/2N2(g)+3/2H2(g)=NH3(g) △H=-46.1 kJ·mol-1
(2)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(l);△H=-1366.8 kJ·mol-1
(3)C(石墨s)+H2O(g)="=" CO(g)+ H2(g);△H=131.3 kJ·mol-1
II(1)放出 吸热 放热 (2)①化学 电 ②Zn为活泼金属,作负极。
本题难度:简单
4、填空题 某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。

请回答下列问题:
(1)请按气体流向连接实验装置B→ →C→A→D→ (用装置编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式 。
② 除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
参考答案:(1)A; D;(2)H2O2和MnO2或Na2O2和H2O;赶出装置中的二氧化碳和水蒸气等;将燃烧生成的二氧化碳和水蒸气彻底排出,并完全吸收;(3)C2H6O;
(4)① CH3COOH + C2H5OH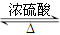 CH3COOC2H5 + H2O CH3COOC2H5 + H2O
② 饱和Na2CO3溶液、分液漏斗
(5)C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H="-1367" kJ/mol
本题解析:(1)根据实验的目的、原理及装置的作用确定装置的连接次序;本实验为燃烧法确定有机物的组成。实验过程中,为保持测定结果的准确性,必须防止空气中二氧化碳和水蒸气的干扰。装置B为氧气的发生装置,制得的氧气中含有水蒸气,必须除去,应连接装有浓硫酸的洗气瓶,然后连接装置C,发生主体反应,再用装有浓硫酸的洗气瓶吸收水蒸气,用装有碱石灰的U形管吸收二氧化碳,最后再用装有碱石灰的U形管防止空气中二氧化碳和水蒸气的干扰,按气体流向连接实验装置B→A →C→A→D→D;(2)B装置为固液不加热制气体的发生装置,用该装置制O2时所用的药品是H2O2和MnO2或Na2O2和H2O;实验中,为保持测定结果的准确性,必须防止空气中二氧化碳和水蒸气的干扰,则开始对C装置加热之前,要通一段时间的氧气,目的是赶出装置中的二氧化碳和水蒸气等;停止加热后,也要再通一段时间的氧气,目的是将燃烧生成的二氧化碳和水蒸气彻底排出,并完全吸收;(3)根据题意知,A装置增重的2.7g为生成水的质量,物质的量为0.15 mol ,则有机物中氢原子的物质的量为0.3mol,氢元素质量为0.3g;D装置增重的4.4g为二氧化碳的质量,物质的量为0.1mol,则有机物中碳原子的物质的量为0.1mol,碳元素质量为1.2g;则有机物中一定含有氧元素。氧元素质量为:m(O)=2.3-1.2-0.3=0.8g,氧原子的物质的量为0.05mol,所以实验式为:C2H6O;(4)根据X的实验式及题给信息判断,X为乙醇,Y为乙酸,Z为乙酸乙酯。①实验二中的反应为乙酸和乙醇的酯化反应,化学方程式CH3COOH + C2H5OH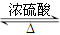 CH3COOC2H5 + H2O;② 除去乙酸乙酯中混有的乙酸所需的试剂为饱和Na2CO3溶液,方法为分液,用到的主要仪器是分液漏斗;(5)根据题给信息写出乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H="-1367" kJ/mol。 CH3COOC2H5 + H2O;② 除去乙酸乙酯中混有的乙酸所需的试剂为饱和Na2CO3溶液,方法为分液,用到的主要仪器是分液漏斗;(5)根据题给信息写出乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H="-1367" kJ/mol。
考点:考查化学实验基本操作,有机物分子式和结构式的确定、乙醇的性质、热化学方程式的书写。
本题难度:困难
5、选择题 下列说法中正确的是
A.在任何物质分子中都含有化学键
B.HF、HCl、HBr、HI的沸点依次升高
C.D2O分子与H2O分子是所含电子总数不相等的分子
D.CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
参考答案:D
本题解析:稀有气体元素的最外层电子已经达到稳定结构,所以稀有气体分子中没有化学键,A不正确。氟化氢中存在氢键,所以沸点最高,顺序为HF>HI>HBr>HCl,B不正确。质子数等于核外电子数,所以D2O和H2O中所含有的电子数是相等的,C不正确。CO2、PCl3分子中所有原子的化合价的绝对值和该原子的最外层电子数之和等于8,所以均满足8电子稳定结构,D正确。答案选D。
本题难度:一般
|