预期现象和结论1:?②?;
预期现象和结论2:?③?;
参考答案:(14分)(1)A:H2SO4? B:Ba(OH)2? (2)Ag++Cl-=AgCl↓?(各2分,共6分)
(3) NH4HCO3? NH4++HCO3-+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O?(各2分,共4分)
(4) ①向其中加入足量的Ba(OH)2溶液;?(2分)
②若开始有白色沉淀生成,最终无沉淀生成,则C为AlCl3;
③若自始至终有白色沉淀生成,则C为MgCl2?(各1分,共2分)
(或:①向其中加入溶液NH4HCO3;②若既有气体又有白色沉淀生成,则C为AlCl3;③若无任何现象,则C为MgCl2。? (其它方法正确也给分)
本题解析:(1)0.1 mol/L A溶液的pH<1,这说明A应该是二元强酸,所以A是硫酸。将B溶液分别与其它四种溶液混合,均有白色沉淀生成,这说明B中含有OH-和Ba2+,即B是氢氧化钡,且一定不存在硝酸铵或氯化铵。
(2)C溶液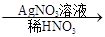 白色沉淀,说明C中含有氯离子,反应的离子方程式是Ag++Cl-=AgCl↓。 白色沉淀,说明C中含有氯离子,反应的离子方程式是Ag++Cl-=AgCl↓。
(3)又因为HCO3-和Al3+不能大量共存,又一定不存在硝酸铵或氯化铵,所以D、E两种物质中必有一种是NH4HCO3。则将少量该物质的溶液滴加到B溶液中反应的离子方程式NH4++HCO3-+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O,
(4)根据以上分析可知,C是氯化铝或氯化镁,而另外一种物质是硝酸镁或硝酸铝。因此可以根据氢氧化铝的两性进行检验,所以要检验C的成分,正确的操作应该是①向其中加入足量的Ba(OH)2溶液;②若开始有白色沉淀生成,最终无沉淀生成,则C为AlCl3;③若自始至终有白色沉淀生成,则C为MgCl2。
(或:①向其中加入溶液NH4HCO3;②若既有气体又有白色沉淀生成,则C为AlCl3;③若无任何现象,则C为MgCl2。)
点评:该题综合性强,难度较大,对学生的思维能力要求高,学生不易得分。试题在注重对学生基础知识巩固和检验对同时,侧重对学生答题能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的学习效率和学习积极性。注意基础知识的积累、总结和运用。
本题难度:一般
3、实验题 (13分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】用葡萄糖制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:?。甲同学还发现用同浓度FeCl3,Fe(NO3)3溶解银镜,FeC l3溶液溶解Ag的反应更快更完全,请解释其原因: l3溶液溶解Ag的反应更快更完全,请解释其原因:
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不要求写具体操作过程)
| 预期现象和结论
| ①
②
……
| 若银镜消失,假设2成立。
若银镜不消失,假设2不成立。
|
【思考与交流】
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论?,并简述理由:?。
参考答案:(1)Fe3++Ag= Fe2++Ag+(2分)? FeCl3中Cl-与Ag+生成AgCl,促进正向反应完全。(2分)
(2)①测定上述实验用的Fe(NO3)3溶液的pH;(2分)
本题解析:略
本题难度:简单
4、填空题 某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验

步骤如下:
①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是 ?。
(2)步骤①无明显现象,原因是?。
(3)步骤④的主要现象是?,有关反应的离子方程式是?。
(4)学习小组在进行实验后发现该实验装置存在着一种明显的缺陷,请给出一种简单
的消除此缺陷的措施:?。
参考答案:(1)(胶头)滴管?(2)常温下铁在浓硝酸中钝化?(3)溶液变成血红色
(3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O)Fe3+ + 3SCN- = Fe(SCN)3(前面括号内的反应不答不扣分)
(4)管口塞蘸有碱液的棉花团
本题解析:略
本题难度:一般
5、实验题 (11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→?
(仪器与药品可重复使用)。

(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
参考答案:(11分)
(1)只有SO2(或H2)(1分)?只有 H2(或SO2(1分)) H2(或SO2(1分))
(2)f→g→d→e→f→g→b→c→h? (或f g →d e→ f g →b c →h )(2分,见错得0分)
(3)用试管从h口收集气体验纯,再于h尖嘴处点燃,并用干燥烧杯罩在火焰上方,若内壁有液滴,证明有氢气产生。(2分,若无验纯,扣1分,其它合理答案参照给分)
(4)开始锌与较浓硫酸反应产生SO2,反应一段时间后,硫酸浓度变小,锌与稀硫酸反应产生H2。(2分)
(5)5:2(3分)
本题解析:略
本题难度:一般
|