微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
参考答案:CD
本题解析:容器Ⅰ中反应正向进行,放出热量,容器Ⅱ中反应逆向进行,吸收热量,两个容器中反应温度不同,则Ⅰ、Ⅱ中正反应速率不相同,A错。容器Ⅲ中加入反应物的量比容器Ⅰ中多,由于该反应为放热反应,Ⅲ中放出热量比Ⅰ多,Ⅲ中反应正向进行的程度比Ⅰ小,因此容器Ⅲ中反应的化学平衡常数比Ⅰ小,B错。?Ⅰ中反应正向进行,放出热量,Ⅱ中反应逆向进行,吸收热量,由于容器均为绝热容器,Ⅰ和Ⅱ中反应进行的程度均较小,则C、D均正确。
本题难度:一般
2、选择题 如下图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)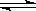 2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是

A.反应速率:v(B)>v(A) B.A容器中X的转化率为80%
C.平衡时Y体积分数:A<B D.打开活塞K重新达平衡VA=2.2aL
参考答案:D
本题解析:A.对X (g)+Y(g)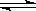 2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减下,其反应速率也要减小.对于B容器来说,体积不变,各组分初始浓度是A容器的2倍,每个时刻的反应速率都将大于A容器,即反应速率:v(B)>v(A),A正确;B.根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2mol=2.8mol,即增加了0.8mol,根据化学方程式的计算可知,
2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减下,其反应速率也要减小.对于B容器来说,体积不变,各组分初始浓度是A容器的2倍,每个时刻的反应速率都将大于A容器,即反应速率:v(B)>v(A),A正确;B.根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2mol=2.8mol,即增加了0.8mol,根据化学方程式的计算可知,
X (g)+Y(g)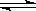 =2Z(g)+W(g)△n
=2Z(g)+W(g)△n
1 1
0.8mol 0.8mol
即达平衡后,反应掉0.8mol,A容器中X的转化率为80%,B正确;C.根据C项中A容器的平衡变化,建立新平衡后,(容积为0.5aL与容积为1.4aL相比)Y的体积分数要减小,即平衡时Y体积分数A<B,C正确;D.打开K达新平衡等效为A中到达的平衡,X的转化率为80%,参加反应的X的总的物质的量为3mol×80%=2.4mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
2.4mol 2.4mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+2.4mol=8.4mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL×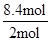 =4.2aL,则A的体积=4.2aL-a=3.2a,D错误;答案选D。
=4.2aL,则A的体积=4.2aL-a=3.2a,D错误;答案选D。
考点:考查化学平衡的影响因素及计算。
本题难度:一般
3、选择题 11.100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的
A.碳酸钠(固体)
B.水
C.硫酸钾溶液
D.CH3COONa(固体)