微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 化学--选修2:化学与技术
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产.即在反应器中碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
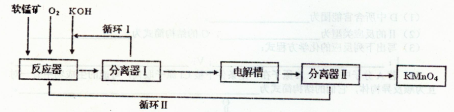
回答下列问题:
(1)写出反应器中反应的方程式______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因______.
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:______阳极:______.
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:K2MnO4+CO2=KMnO4+MnO2+K2CO3将所得到的KMnO4配成0.1mol?L-1 KMnO4溶液,滴定20.00mL未知浓度的FeCl2液,消耗KMnO4溶液30.00mL.滴定达到终点时的现象为:______,则FeCl2溶液的浓度为______mol/L.
参考答案:(1)二氧化锰和氢氧化钾、氧气发生生成锰酸钾和水,反应的化学方程式为4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,所以氧化铝和强碱反应生成偏铝酸盐和水,反应的离子方程式为2OH-+Al2O3=2AlO2-+H2O,
故答案为:2OH-+Al2O3=2AlO2-+H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,
故答案为:阴极:2H2O+2e-=H2↑+2OH-,阳极:2MnO42--2e-=2MnO4-;
(4)氯化亚铁有还原性,高锰酸钾有强氧化性,所以氯化亚铁能被高锰酸钾氧化成氯化铁,故滴定达到终点时的现象为:溶液从浅绿色变为紫红色并且在30秒内不褪色;
设氯化亚铁溶液的浓度为C.
5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O
5mol? 1mol
0.02Cmol? 0.003mol
C=0.75mol?L-1
故答案为:溶液从浅绿色变为紫红色并且在30秒内不褪色;0.75.
本题解析:
本题难度:一般
2、选择题 下列溶液中,Cl-的浓度最大的是( )
A.7.5mL2mol/LMgCl2溶液
B.30mL1mol/LKCl溶液
C.10mL3mol/LNaCl溶液
D.30mL0.5mol/LAlCl3溶液
参考答案:A、7.5mL 2mol/LMgCl2溶液中氯离子的物质的量浓度=2mol/L×2=4mol/L;
B、30mL 1mol/LKCl溶液中氯离子的物质的量浓度=1mol/L×1=1mol/L;
C、10mL 3mol/L NaCl溶液中氯离子的物质的量浓度=3mol/L×1=3mol/L;
D、30mL 0.5 mol/L AlCl3溶液中氯离子的物质的量浓度=0.5mol/L×3=1.5mol/L;
Cl-的浓度最大的是4mol/L,
故选:A.
本题解析:
本题难度:一般
3、选择题 实验需用480mL?0.5mol?L-1?CuSO4?溶液,在配制CuSO4?溶液过程中下列说法正确的是( )
A.需用480mL的容量瓶
B.需称取38.4g无水CuSO4
C.需称取62.5g的胆矾(CuSO4?5H2O)
D.定容时,用玻璃棒引流小心将烧杯中的蒸馏水加至凹液面与刻度线相切
参考答案:C
本题解析:
本题难度:简单
4、选择题 配置250mL0.100mol/L的氯化钠溶液,操作不正确的是( )
A.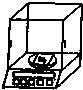
称量
B.
溶解
C.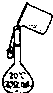
转移
D.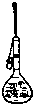
定容
参考答案:A、称量氯化钠采用分析天平更精确,图中实验操作正确;
B、溶解氯化钠时,为了加速其溶解,可以用玻璃棒搅拌,图中实验操作正确;
C、转移时用玻璃棒引流,防流出容量瓶外,图中操作无玻璃棒,图中实验操作错误;
D、定容时用胶头滴管操作,图中实验操作正确;
故选C.
本题解析:
本题难度:一般
5、选择题 用98%、密度为1.84g/cm3的浓H2SO4配制1?mol?L-1的稀硫酸100mL,现给出下列可能用到仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒.按使用仪器先后顺序排列正确的是( )
A.②③⑦⑤⑥
B.②⑤⑦⑥
C.①③⑤⑦④⑥
D.④③⑦⑤⑥
参考答案:A
本题解析:
本题难度:简单