微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
A.溶液中钡离子数目减小
B.溶液中钡离子浓度减小
C.溶液中氢氧根离子浓度增大
D.pH值减小
参考答案:A
本题解析:
【错解分析】本题的另一错解是:当平衡发生移动时,一定会引起相应物质的数量变化。若是讨论某个具体物质的数量,它应该绝对变化,如溶质微粒个数,溶质质量和溶液质量等。但若讨论两个量的比值,在特定条件下可能不变,如溶解度,浓度等。本题讨论溶解平衡(分散系是悬浊液),其溶液为饱和溶液。温度不变时,各种离子的浓度保持不变,选项B、C、D皆与浓度有关,因此不变。而选项A中的钡离子的个数,随着水的量的减少,溶液质量、溶质质量都相应减少,其个数必然减少。
【正解】任何事物都存在矛盾的两个方面,在氢氧化钡溶解平衡中,再加入少量的氢氧化钡粉末,由于溶液中固体不存在浓度问题,思维定势所得的结论:对平衡没有影响。可是选项中所描述的物质,其量都发生变化,与结论相矛盾。从该体系的另一方面分析,是否水的量发生变化?由于加入的氢氧化钡粉末在水中转化结晶水合物,消耗了一定量的水,平衡发生移动。溶解的离子结合生成氢氧化钡的固体,引起溶解物质相应的量发生变化。
本题难度:简单
2、计算题 (8分)1.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b="13" :(1)该温度下水的离子积常数K w的数值为 ??。
(2)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=?。(写出计算过程)
(3)常温下pH=5的H2SO4的溶液稀释500倍后,溶液中SO42-的浓度与H+浓度的比值约为?(写出计算过程)
参考答案:(1)10-13或1.0×10-13?(2分)?(2)12?(4分)?(3)1:10(2分)
本题解析:略
本题难度:一般
3、选择题 在室温下将pH=3的硫酸溶液与pH=12的烧碱溶液混合溶液后溶液pH=11,则硫酸与烧碱溶液的体积之比是
A.9:2
B.2:9
C.9:4
D.9:1
参考答案:A
本题解析:混合溶液的pH=11,溶液中的c(OH—)=1×10—3mol·L-1=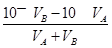 ,解之得:
,解之得: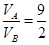 ,答案为A
,答案为A
本题难度:一般
4、选择题 25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
参考答案:A
本题解析:酸或碱都是抑制水的电离的,而盐类的水解则是促进水的电离的。所以①②中发生电离的水的物质的量分别是10-14、10-13。③④促进水的电离,所以发生电离的水的物质的量分别是10-4、10-5,因此发生电离的水的物质的量之比是1∶10∶1010∶109,答案选A。
点评:在计算发生电离的水时,需要根据溶液的性质,而不能只具有溶液的pH,这是由于酸或碱都是抑制水的电离的,而盐类的水解则是促进水的电离的。
本题难度:一般
5、填空题 磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5,现将3.1g的单质磷(P)在3.2g氧气中燃烧至反应物耗尽,并放出XkJ的热量。
(1)反应后生成物的组成(用化学式表示)是____________________。
(2)已知单质磷的燃烧热为YkJ/mol,则1molP与O2反应生成固态P2O3的反应热ΔH=_______________。
(3)若3.1g磷在3.6g氧气中燃烧,至反应物耗尽,并放出ZkJ的热量,则X___________Z(填“<”“>”或“=”)
(4)磷的两种氧化物中,较稳定的是_______________。
参考答案:(1)P2O3、P2O5
(2)-(20X-Y)KJ/mol
(3)<
(4)P2O5
本题解析:
本题难度:一般