微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液,加热后颜色变浅的是
A.稀氨水和酚酞溶液
B.滴有酚酞的Na2CO3溶液
C.溶有氯气的品红溶液
D.溶有SO2的品红溶液
参考答案:A
本题解析:略
本题难度:简单
2、选择题 常温下,向25mL0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是

A.只有在A、B间任一点,溶液中才有:
c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:BC
本题解析:考查中和滴定及粒子浓度的浓度
A:混合溶液中只有四种粒子,任何时候都遵循电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B:当a=25ml时,酸碱恰好中和,生成CH3COONa溶液,水解呈碱性,B点时,溶液pH=7,呈中性,则需要再多加一些醋酸,即a>25ml;中性溶液中,c(OH-)=c(H+),必须有c(Na+)=c(CH3COO-),且c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C:B点时c(Na+)=c(CH3COO-)>c(OH-)=c(H+),再滴加醋酸,溶液中的c(CH3COO-)、c(H+)增大,则必然导致c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D:D点时醋酸的物质的量为NaOH的两倍,由物质守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+)
答案为BC
本题难度:一般
3、选择题 下列有关电解质溶液关系正确的是
A.分别向pH=2的盐酸和醋酸溶液中,加水稀释到pH=4,消耗水的体积相等
B.等物质的量浓度的氯化钠和醋酸钠溶液中,微粒关系有c(Na+)= c(Cl-)+c(CH3COO-)
C.在NaHSO3溶液微粒由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
D.若弱酸的酸性H2A>H2B,则等物质的量浓度等体积的Na2A、Na2B溶液中,阴离子数目前者大于后者
参考答案:C
本题解析:选项A中盐酸为强酸,醋酸为弱酸,加水稀释时醋酸消耗水的体积大。选项B中油正负电荷守恒得c(Na+)+c(H+)= c(Cl-)+c(CH3COO-)。选项D中H2A酸性强于H2B,B2-离子与氢离子结合的能力强于A2-离子,因此Na2A的碱性弱于Na2B。再根据c(Na+)+c(H+)=c(A2-)+c(OH-) ,
c(Na+)+c(H+)=c(A2-)+c(OH-),Na+浓度相同,A中的c(H+)大于B中c(H+),可得Na2A溶液中的阴离子数多
点评:本题关键在于会利用物料守恒,及溶液的性质来判断离子浓度的大小。
本题难度:简单
4、选择题 向27.2g Cu和Cu2O(物质的量之比为2︰1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 。在所得溶液中加入1.0 mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是
A.混合物中Cu的物质的量为0.2 mol
B.产生的NO在标准状况下的体积为4.48L
C.硝酸的物质的量浓度为2.6mol/L
D.Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:C
本题解析:A、设Cu2O的物质的量为 mol,则Cu的物质的量为
mol,则Cu的物质的量为 mol,则可得等式:
mol,则可得等式: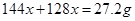 ,解得
,解得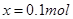 ,则
,则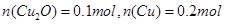 。故选项A正确。
。故选项A正确。
B、混合物与稀硝酸反应,生成Cu(NO3)2 的物质的量为0.4mol。转移的电子数为0.6mol,设生成NO的物质的量为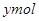 ,则可得关系式:
,则可得关系式: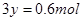 ,解得
,解得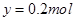 ,因此其在标准状态下的体积
,因此其在标准状态下的体积 。因此选项B正确。
。因此选项B正确。
C、混合物反应生成Cu(NO3)2 的物质的量为0.4mol,需消耗硝酸0.8mol,又反应生成0.2mol的NO,需硝酸0.2mol。因此总共需要硝酸的物质的量为1mol;又混合物与酸反应后硝酸剩余0.2mol,因此整个过程中硝酸的物质的量为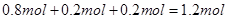 ,其浓度
,其浓度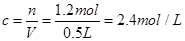 ,故选项C说法错误。?
,故选项C说法错误。?
D、混合物反应生成Cu(NO3)2 的物质的量为0.4mol,可知与NaOH反应生成的Cu(OH)2的物质的量为0.4mol,需要NaOH的物质的量为0.8mol。而整个反应消耗的NaOH的物质的量为1mol,因此有0.2mol的NaOH与硝酸反应,故选项D正确。综上,答案选C。
点评:金属与硝酸的反应属于中学化学的重点内容,应重点掌握。需注意硝酸无论浓稀均具有氧化性。同时在做此类涉及计算的选择题时,应利用好质量守恒定律。
本题难度:简单
5、选择题 在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液中,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A.HNO2
B.HCOOH
C.HCN
D.H2CO3
参考答案:C
本题解析:略
本题难度:一般