微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=______.(用含△H1、△H2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
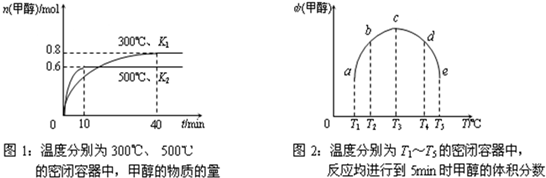
a.该反应的△H3______0(选填“<”、“>”或“=”,下同),K1______K2.
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有______.
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为______.
(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:
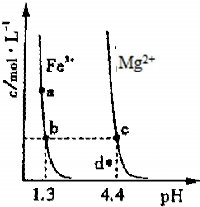
该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]______Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
______.
参考答案:(1)①2C(s)+O2(g)=2CO(g)△H1? ①
?2H2(g)+O2(g)=2H2O(g)△H2? ②
盖斯定律得①-②得:2C(s)+2H2O(g)?2CO(g)+2H2(g)△H1-△H2,
则反应C(s)+H2O(g)?CO(g)+H2(g)△H=△H1-△H?22,故答案为:△H1-△H?22;
?②a.图1可以看出,甲醇的物质的量为0.6mol的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以△H3<0,故答案为:<;
因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大,故答案为:>;
b.因正反应为放热反应,同时是气体化学计量数减小的反应,所以可通过升温、减压等措施使平衡逆向移动,故答案为:升温、减压;
(2)电池的总反应为:2CO+O2=2CO2,正极反应为2CO2+O2+4e-=2CO32-,所以负极的电极反应式为:CO+CO32--2e-=2CO2,故答案为:CO+CO32--2e-=2CO2,
(3)由b、c两点得:KSP[Fe(OH)3]=c(Fe3+)?(OH-)3=c(Fe3+)?(10-12.7)3,而KSP[Mg(OH)2]=c(Mg2+)?(OH-)2=c(Mg2+)?(10-9.6)2,因c(Fe3+)=c(Mg2+),所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
本题解析:
本题难度:一般
2、选择题 已知反应:
H2(g)+?1/2O2(g)=H2O(g)?△H1 ?
1/2N2(g)+O2(g)=NO2(g)?△H2? ?
1/2N2(g)+3/2H2(g)=NH3(g)?△H3?
则反应2NH3(g)+?O2(g)=2NO2(g)+3H2O(g)的△H为
[? ]
A.?2△H1+2△H2-2△H3?
B.?△H1+△H2-△H3
C.?3△H1+2△H2+2△H3?
D.?3△H1+2△H2-2△H3
参考答案:D
本题解析:
本题难度:一般
3、简答题 把煤作为燃料可通过下列两种途径:
途径I:煤直接燃烧C(s)+O2?(g)═CO2(g)△H1<0?①
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0?②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0?③
2H2(g)+O2?(g)═2H2O(g)△H4<0?④
请回答下列问题:
(1)燃烧等量的煤,途径I放出的热量______(填“大于”“等于”或“小于”)途径II放出的热量,其理论依据是______;
(2)△H1、△H2、△H3、△H4的数学关系式是______.
参考答案:(1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量.
故答案为:等于;盖斯定律.
(2)途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0?②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0?③
2H2(g)+O2?(g)═2H2O(g)△H4<0?④
由盖斯定律可知,②×2+③+④得2C(s)+2O2?(g)═2CO2(g)△H=2△H2+△H3+△H4.
所以△H1=12△H=12(2△H2+△H3+△H4)=△H2+12(△H3+△H4).
故答案为:△H1=△H2+12(△H3+△H4).
本题解析:
本题难度:一般
4、填空题 已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是____________。
(2)H2有燃烧热为____________;C的燃烧热为____________。
(3)燃烧10g H2生成液态水,放出的热量为____________。
(4)写出CO燃烧的热化学方程式__________________________________。
参考答案:(1)①②③④
(2)285.8 kJ/mol;393.5 kJ/mol
(3)1429 kJ
(4)CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ/mol
本题解析:
本题难度:一般
5、简答题 (1)已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H>0,请回答下列问题.
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为______(填序号).
A.加入一定量M?B.降低反应温度?C.升高反应温度
D.缩小容器体积?E.加入催化剂?F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为______;若保持温度不变,起始反应物的浓度改为:c(M)=4mol?L-1,c(N)=a?mol?L-1,达到平衡后,c(P)=2mol?L-1,则a=______mol?L-1.
(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe?固体和CO2气体的热化学反应方程式:______.
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=______.
[已知Ksp(Ba?SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
参考答案:(1)①A、加入一定量M,虽然平衡向正反应方向移动,但加入的多,转化的少,M的转化率减小,故A错误;?
B、该反应的正反应为吸热反应,温度降低,平衡向逆反应方向移动,M的转化率减小,故B错误;
C、该反应的正反应为吸热反应,温度升高,平衡向正反应方向移动,M的转化率增大,故C正确;
D、缩小容器体积,压强增大,平衡不移动,转化率不变,故D错误;
E、加入某物质作催化剂,平衡不移动,转化率不变,故E错误;
F、分离出一定量P,平衡向正反应方向移动,M的转化率增大,故F正确,
故答案为:CF;
②达到平衡后,M的转化率为60%,则M的转化的物质的量浓度为1mol/L×60%=0.6mol/L,根据反应的方程式可知N的浓度变化量为0.6mol/L,
所以N的转化率为:0.6mol/L2.4mol/L×100%=25%,
平衡时P、Q的物质的量浓度为0.6mol/L,M的浓度为0.4mol/L,N的浓度为1.8mol/L,
所以该温度下的平衡常数为k=0.6×0.60.4×1.8=0.5,
反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,则生成的Q为2mol?L-1,
平衡时c(M)=2mol?L-1,c(N)=(a-2)mol?L-1;
温度不变,则平衡常数不变,则2×22×(a-2)=0.5,解得a=6,
故答案为:25%;6;
(2)已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1,
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1,
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1,
根据盖斯定律,①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即?CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(3)Ksp(Ba?SO4)=c(Ba2+)(SO42-)=1.3×10-10;Ksp(BaCO3)=c(Ba2+)c(CO32-)=2.6×10-9,
所以c(CO32-):c(SO42-)=Ksp(BaCO3):Ksp(Ba?SO4)=2.6×10-9:1.3×10-10=20:1,
故答案为:20:1.
本题解析:
本题难度:一般