微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学研究的正确说法是( ? )
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从H2S、HCl的酸性:H2S<HCl,可以推出非金属性:S<Cl
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知298K时下述反应:
①C(s)+1/2O2(g)=CO(g)△H1=-110.5kJ?mol-1
②CO(g)+1/2O2(g)=CO2(g)△H2=-283.0kJ?mol-1
③C(s)+CO2(g)=2CO(g)△H3,
则△H3等于( ? )
A.172.5kJ?mol-1
B.-172.5kJ?mol-1
C.393.5kJ?mol-1
D.-393.5kJ?mol-1
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
[? ]
A.-317.3kJ·mol-1
B.-379.3kJ·mol-1
C.-332.8kJ·mol-1
D.+317.3kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
4、简答题 减少污染、保护环境是全世界最热门的课题.
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+
O2(g)═H2O(g)△H1=-241.8kJ?mol-1;
C(s)+O2(g)═CO(g)△H2=-110.5kJ?mol-1则焦炭与水蒸气反应生成CO的热化学方程式为______.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是______(填序号):
a.Ca(OH)2b.CaCl2 c.Na2CO3d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如图1所示.
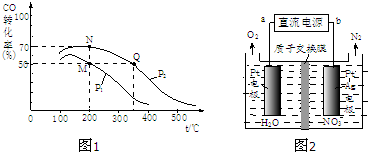
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=______.
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为______.
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染.
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则该反应离子方程式为______.
②电化学降解NO3-的原理如图2所示,电源正极为______(填“a”或“b”);若总反应为4NO3-+4H+5O2↑+2N2↑+2H2O,则阴极反应式为______.
参考答案:(1)①H2(g)+12O2(g)=H20 (g)△H=-241.8kJ?mol-1 ①
C(s)+12O2(g)=CO (g)△H=-110.5kJ?mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂;二氧化硫与氯化钙溶液不反应,且在亚硫酸氢钠溶液中的溶解度很小,所以不能用氯化钙和亚硫酸氢钠溶液做洗涤液,故答案为:ac;
(2)①A点CO的转化率为0.5,则参加反应的CO为10mol×0.5=5mol,则:
CO(g)+2H2(g)?CH3OH(g)气体物质的量减少
12
5mol 10mol
故A点平衡时,混合气体总的物质的量=10mol+20mol-10mol=20mol,
B点CO的转化率为0.7,则参加反应的CO为10mol×0.7=7mol,则:
CO(g)+2H2(g)?CH3OH(g)气体物质的量减少
12
7mol 14mol
故B点平衡时,混合气体总的物质的量=10mol+20mol-14mol=16mol
故A、B两点时容器内总气体的物质的量之比n(A):n(B)=20mol:16mol=5:4,
故答案为:5:4;
②由图可知,一定压强下,温度越高,CO的转化率越低,说明升高稳定平衡向逆反应方向移动,B的温度高于C点,故平衡常数KM>KQ=KN,
故C答案为:KM=KN>KQ;
(3)①根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2催化剂.N2+2OH-+4H2O,
故答案为:2NO3-+5H2催化剂.N2+2OH-+4H2O;
②根据装置图示可以看出,右端电极上发生得电子的还原反应,即为阴极,反应式为:2NO3-+12H++10e-=N2↑+6H2O,所以B是负极,A是正极,
故答案为:a;2NO3-+12H++10e-=N2↑+6H2O.
本题解析:
本题难度:一般
5、选择题 已知热化学方程式:
①?C2H2(g)?+?5/2O2(g)?==?2CO2(g)+H2O(l)?ΔH1=-1301.0?kJ·mol-1
②?C(s)+?O2(g)?==?CO2(g)?△H2=-393.5?kJ·mol-1
③?H2(g)+?1/2O2(g)?==?H2O(1)?△H3?=?-285.8?kJ·mol-1
则反应④?2C(s)+?H2(g)?==?C2H2(g)的△H为
[? ]
A.?+228.2?kJ·mol-1?
B.?-228.2?kJ·mol-1?
C.?+1301.0?kJ·mol-1?
D.?+621.7?kJ·mol-1
参考答案:A
本题解析:
本题难度:一般