| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》考点强化练习(2017年押题版)(十)
参考答案:B 本题解析:A不正确,没有配平;C中电子的得失不守恒,不正确;氨水是弱电解质,用化学式表示,D不正确,所以正确的答案选B。 本题难度:一般 2、简答题 (18分)水是组成生命体的重要化学物质,有关水的反应有很多。 参考答案: 本题解析: 本题难度:困难 3、选择题 下列反应的离子方程式书写不正确的是 |
参考答案:
本题解析:
本题难度:一般
4、填空题 (本题3个空,每空2分,共6分)
在盛有100mL浓硝酸的试管中加入32g铜片发生反应。请回答:
(1)开始阶段,反应的离子方程式是 。
(2)若二者恰好完全反应,共产生气体11.2L(标准状况)。则浓硝酸的物质的量浓度为 。
(3)反应结束后的试管中,再加入金属铜和入少量20%的稀硫酸,这时溶液中又有气泡产生,请写出反应的离子方程式是 。
参考答案:(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2)15mol·L-1。
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
本题解析:(1)铜与硝酸反应与其浓度有关:Cu + 4HNO3(浓)= Cu(NO3)2+ 2NO2↑ + 2H2O
3Cu + 8HNO3(稀)=3Cu(NO3)2+ 2NO↑ + 4H2O,开始阶段为第一个反应。(2) 恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L物质的量为0.5mol,铜物质的量为0.5mol。依据氮元素守恒得到,原硝酸溶液中溶质物质的量=0.5+0.5×2=1.5mol;原硝酸浓度=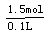 =15mol/L。(3)溶液中的NO3-在酸性条件下又具有氧化性,离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
=15mol/L。(3)溶液中的NO3-在酸性条件下又具有氧化性,离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
考点:考查硝酸的化学性质。
本题难度:一般
5、选择题 下列离子方程式正确的是
A.钠与水反应: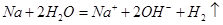
B.硅酸钠溶液与醋酸溶液混合: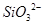 +
+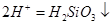
C.0.01mol/LNH4Al 溶液与0.02mol/LBa(OH)2溶液等体积混合:
溶液与0.02mol/LBa(OH)2溶液等体积混合: 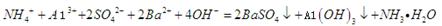
D.向次氯酸钙溶液通入
参考答案:C
本题解析:A、离子方程式没有配平,电话不守恒,故A错误;B、醋酸为弱酸,不能拆成离子,故B错误;C、0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合,NH4+、Al3+与OH?物质的量之比为1:1:4,离子方程式正确,故C正确;D、HClO具有强氧化性,不能生成具有还原性的CaSO4,应生成CaSO4,故D错误。
考点:本题考查离子方程式。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《电解质和非.. | |