|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》考点强化练习(2017年押题版)(一)
2017-07-27 11:16:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+===CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2===2Cl-+I2
D.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
|
2、填空题 (10分)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。请回答下列问题:
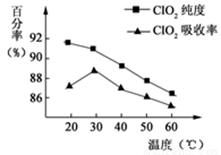
(1)由图可知,反应时需要控制的适宜温度是 ℃。
(2)黄铁矿中的硫元素在酸性条件下被ClO3—氧化成SO42—,写出制备二氧化氯的离子方程式 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得500mLClO2溶液,取出25.00mL,加入42.00mL0.500mol·L—1(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500mol·L—1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下:
4H++ClO2+5Fe2+==Cl—+5Fe3++2H2O
14H++Cr2O72—+6Fe2+ ==2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(请写出计算过程)。
3、填空题 废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
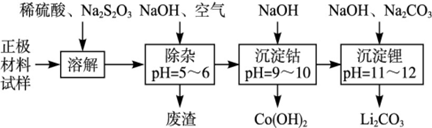
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
4、选择题 下列离子方程式中正确的是
A.碳酸钠溶液与石灰乳的反应:CO32-+Ca2+===CaCO3↓
B.硝酸银溶液与食盐水的反应:Ag++Cl-===AgCl↓
C.锌与盐酸的反应:Zn+2H++2Cl-===Zn2++2Cl-+H2↑
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O===Fe(OH)3↓+3H+
|
5、选择题 能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是 ( )
①Ba(OH)2和NaHSO4:Ba2+ +2OH- +2H+ +SO42—=BaSO4↓+ 2H2O
②Ba(OH)2和NaHSO4:Ba2+ + OH-+ H++ SO42—=BaSO4↓+ H2O
③ Ba(OH)2和KAl(SO4)2:2Ba2+ + 4OH-+ Al3++ 2SO42-=2BaSO4↓+ AlO2-
④Ba(OH)2和KAl(SO4)2:3Ba2+ + 6OH-+ 2Al3++ 3SO42-=3BaSO4↓+2Al(OH)3↓
A.③④
B.②④
C.①③
D.①④